微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于化学反应与能量的说法不正确的是
A.燃烧反应都属于放热反应
B.新型二次电池对环境无污染,可以不回收
C.原电池能使氧化还原反应释放的能量直接转化为电能
D.反应中能量变化的大小与反应物的质量多少有关
参考答案:B
本题解析:略
本题难度:简单
2、填空题 (6分)用VSEPR 理论判断:
物质
| 孤对电子对数
| 轨道杂化形式
| 分子或离子的形状
|
NH4+
| ?
| ?
| ?
|
NCl3
| ?
| ?
| ?
参考答案:(6分)用VSEPR理论判断:(各1分)
物质
本题解析:由公式:孤对电子对数=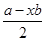 可求得NH4+为0、NCl3为1,价层电子对数分别为4、3,则轨道杂化形式均为Sp3,但微粒形状分别为正四面体和三角锥形。 可求得NH4+为0、NCl3为1,价层电子对数分别为4、3,则轨道杂化形式均为Sp3,但微粒形状分别为正四面体和三角锥形。
本题难度:一般
3、选择题 下列叙述正确的是(????)
A.非金属原子间以共价键结合的物质都是共价化合物
B.制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找
C.1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热
D.铷的熔点比钠低,其硫酸盐易溶于水
参考答案:B
本题解析:
试题分析:A、因氢气、氧气、氮气中存在共价键,但属于单质,故A错误 ;
C、因强酸与强碱生成1mol水所释放的热量称为中和热,1mol氢氧化钡与足量盐酸发生中和反应生成2mol水,故C错误;
D、铷的熔点比钠高,其硫酸盐易溶于水,故D错误;
故选B。
点评:本题考查化学键、中和热、原电池、电离等知识,明确化学键与共价化合物、离子化合物的关系、中和热的概念等即可解答,难度不大。
本题难度:简单
4、选择题 下列有关能量的判断或表示方法正确的是
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多
B.从C(石墨)=C(金刚石)△H=+1.9kJ·mol-1,可知石墨比金刚石更稳定
C.2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:
2H2(g)+O2(g)=2 H2O(l)△H=-285.8 kJ·mol-1
D.由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ·mol-1,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ
参考答案:B
本题解析:
试题分析:A、等质量的硫蒸气比硫固体的能量高,放出的热量多,错误;B、石墨变金刚石吸热,所以石墨比金刚石更稳定,正确;C、2g氢气的物质的量是1mol,2mol氢气完全燃烧放出的热量是571.6kJ,错误;D、CH3COOH为弱酸,电离吸收热量,所以与氢氧化钠反应生成1mol水放出热量小于57.3 kJ ,错误,答案选B。
考点:考查化学反应能量的判断
本题难度:一般
5、选择题 可逆反应:A(g)  B(g),其反应过程中能量变化如下图所示,下列说法错误的是 B(g),其反应过程中能量变化如下图所示,下列说法错误的是
(以Ea表示活化能,Ea(正)、Ea(逆)分别表示正、逆反应活化能)

A.该反应的 ΔH = Ea(正) - Ea(逆)
B.该反应的Ea(正) = E3 - E2
C.只要温度升高,该可逆反应就会向逆反应方向进行
D.可逆反应B(g)  A(g)的ΔH = E2- E1 A(g)的ΔH = E2- E1
参考答案:C
本题解析:
试题分析:A、根据图像可知反应物的总能量高于生成物的总能量,反应是放热反应,则该反应的 ΔH = Ea(正) - Ea(逆),A正确;B、正方应的活化能=E3 - E2,B正确;C、升高温度平衡向吸热反应反应进行,但在没有达到平衡之前,升高温度平衡不一定向逆反应方向进行,C错误;D、逆反应的反应热与正方应的反应热数值相等,但符号相反,正方应的反应热=E1- E2,因此可逆反应B(g)  A(g)的ΔH = E2- E1,D正确,答案选C。 A(g)的ΔH = E2- E1,D正确,答案选C。
考点:考查反应热、外界条件对平衡状态的影响等
本题难度:一般
|