微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.0.2 mol·L-1 NH3·H2O溶液与0.1 mol·L-1盐酸等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
B.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性:c(CH3COO-)<c(CH3COOH)
C.等物质的量浓度等体积的NH4HSO4溶液和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合所得溶液:c(CO32-)+2c(OH-)=c(HCO3-)+c(H2CO3)+2c(H+)
参考答案:AC
本题解析:
试题分析:A、0.2 mol·L-1 NH3·H2O溶液与0.1 mol·L-1盐酸等体积混合,氨水过量,故c(NH4+)>c(Cl-)>c(OH-)>c(H+),正确;B、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合后呈酸性,那么c(CH3COO-)>c(CH3COOH),错误;C、等物质的量浓度等体积的NH4HSO4溶液和NaOH溶液混合,c(Na+)=c(SO42-)>c(NH4+ )>c(H+)>c(OH-),正确;D、0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合所得溶液: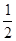 c(CO32-)+c(OH-)=
c(CO32-)+c(OH-)=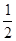 c(HCO3-)+
c(HCO3-)+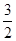 c(H2CO3)+c(H+),错误;故本题选择AC。
c(H2CO3)+c(H+),错误;故本题选择AC。
考点:离子浓度大小的比较
本题难度:困难
2、选择题 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积 变化的曲线如图所示。据图判断正确的是(???)
变化的曲线如图所示。据图判断正确的是(???)

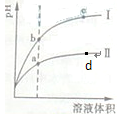

A.Ⅱ为盐酸稀释时pH值变化曲线

B.b点溶液的导电性比c点溶液的导电性强

C.a点Ka的数值比d点Ka的数值大

D.b点酸的总浓度大于a点酸的总浓度
参考答案:B
本题解析:醋酸是弱酸,稀释有利于电离,即在稀释过程中,醋酸的酸性要强于盐酸的,所以Ⅱ为醋酸稀释时pH值变化曲线,为盐酸稀释时pH值变化曲线,A、D不正确。B点对应的氢离子浓度大于c点的氢离子,溶液导电性强,B正确。醋酸的电离常数只与温度有关系,C不正确。答案选B。
本题难度:一般
3、选择题 25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是(??? )
A.I和II中H2O的电离程度不相等
B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小
C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量
D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+)
参考答案:D
本题解析:
试题分析: pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II)中的c(H+)=c(OH﹣)=0.001mol/L,因此对水电离的抑制作用相等,A错误;对I酸溶液进行稀释,溶液中OH-浓度越来越大,B错误;因为I是弱酸,II是强碱,若恰好完全中和得到的醋酸钠溶液也显碱性,所以C错误;若I和II等体积混合,则I中的醋酸过量,所以根据物料守恒c(CH3COO﹣)+ c(CH3COOH>c(Na+),故D正确;故选D。
本题难度:简单
4、选择题 下列离子方程式正确的是(????)
A.亚硫酸钠与盐酸反应:Na2SO3+2H+===2Na2++SO2↑+ H2O
B.碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O
C.稀硫酸与锌反应:H2SO4+Zn=Zn2+ +SO42-+H2↑
D.硫酸溶液与氢氧化钠溶液反应:H++ OH-==H2O
参考答案:D?
本题解析:书写离子方程式时易溶于水且易电离的物质写离子,把单质、氧化物、气体、弱酸、弱碱和水等难电离物质和难溶物质用化学式表示,A中亚硫酸钠应写成离子形式,B中碳酸钙为难溶物质应写化学式,C中稀硫酸应写离子形式。D中硫酸溶液与氢氧化钠均应写离子形式
本题难度:一般
5、选择题 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3?NH4++NH2-据此判断以下叙述中错误的是( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中c(NH4+)?c(NH2-)是一个常数
C.液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
参考答案:A.液氨电离中存在电离平衡,所以液氨中含有?NH3、NH4+
本题解析:
本题难度:简单