微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g)
4C(g) 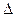 H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B
H >0 达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B 的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
的起始浓度c(B)的取值范围是 ;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量 ②加 压 ③升温 ④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2(选填“<”、“=”、“>”)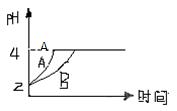
参考答案: 本题解析:略
本题解析:略
本题难度:一般
2、选择题 相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是[???? ]
A.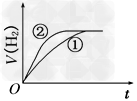
B.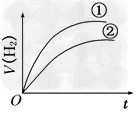
C.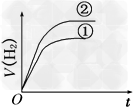
D.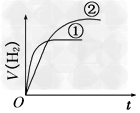
参考答案:C
本题解析:
本题难度:一般
3、选择题 对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.c(H+)=c(CHCOO-)+c(OH-)
B.加入少量CH3COONa固体后,加入,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性
参考答案:B
本题解析:根据电荷守恒,A正确;加入少量CH3COONa固体后,平衡虽向逆向移动,但CH3COO-不能完全抵消,c(CH3COO-)增大了,B错;由于pH=3,溶液中c(H+)=10-3mol/L,根据水的离子委积常数知,由水电离出的c(H+)是1.0×10-11 mol/L,C正确;pH醋酸+pH氢氧化钠=14,且等体积混合,反应后醋酸过量显酸性,D正确。答案选B。
本题难度:一般
4、填空题 有pH均为2的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是??????????(用“>、<、=”表示,下同)。
(2)取同体积的三种酸溶液分别加入足量的锌粉,反应开始放出H2的速率依次为a1、a2、a3,则其关系是?????????????;反应过程中放出H2的速率依次为b1、b2、b3,则其关系是????????????????????
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是????????????????。
参考答案:(1)C3>C1>C2???(2)a1=a2=a
本题解析:略
本题难度:简单
5、选择题 甲、乙、丙、丁、戊五种溶液的溶质分别是HCl、CH3COOH、NaOH、NH3·H2O、Na2CO3中的一种。常温下如下实验:①将0.1 L pH=9的甲溶液分别与a L 0.001 mol/L的乙溶
液、b L 0.001 mol/L的丁溶液充分反应后溶液呈中性时,a>b;②浓度均为0.1 mol/L
的丙和丁溶液等体积混合后,溶液呈酸性;③0.1 mol/L的甲溶液pH小于0.1 mol/L
的戊溶液pH。下列判断正确的是
A.甲的溶质是NH3·H2O
B.乙的溶质是CH3COOH
C.丙的溶质是NaOH
D.戊的溶质是HCl
参考答案:B
本题解析:
由①得出以下结论:甲溶液pH=9说明甲为碱性物质,则乙、丁为HCl和CH3COOH;
中和同样的碱性物质,同浓度时乙的用量大说明乙是弱酸即为CH3COOH;则丁为HCl;由②得出以下结论:由上已知丁为HCl,浓度均为0.1 mol·L-1的丙和丁溶液等体积混合后,溶液呈酸性.
说明丙是弱碱即为NH3·H2O;由③得出以下结论:由上已知甲,戊分别是NaOH或Na2CO3.0.1 mol·L-1的甲溶液pH小于0.1 mol·L-1的戊溶液pH说明戊是强碱NaOH;甲是Na2CO3;
所以:甲是Na2CO3;乙是CH3COOH;丙是NH3·H2O;丁为HCl;戊是NaOH,
故选B.
本题难度:一般