微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某校探究学习小组同学用含有少量杂质(主要为少量泥沙、CaCl2、MgCl2、Na2SO4等)的粗盐制取“化学纯”级的NaCl,实验前他们设计了如下方案(框图)。
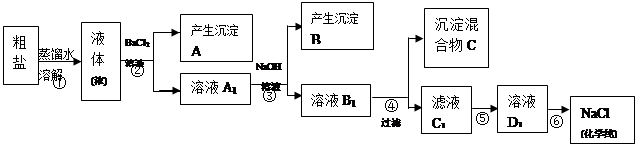
(1)请写出操作第④、⑤步所加试剂名称及第⑥步操作名称:④???????,⑤?????????,⑥??????;
(2) 沉淀混合物C的化学成分有(用文字和化学式表示):??????????????????????????????;
(3)写出第⑤步操作中可能发生反应的离子方程式:
????????????????????????????????????????????????????????????????????????????;
(4)如何用最简单方法检验第⑤步实验是否达到了目的:???????????????????????????????
??????????????????????????????????????????????????????????????????????????????;
(5)你认为该设计里哪些步骤调换后不影响实验结果:?????????????????????????????????;
(6)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:????????????????
????????????????????????????????????????????????????????????????。
参考答案:
⑴④碳酸钠溶液??⑤盐酸??⑥蒸发(蒸发结晶也可)(
本题解析:
试题分析:(1)分析流程图已给出的试剂的作用,BaCl2溶液除去Na2SO4,NaOH溶液除去MgCl2,所以④的作用为除去CaCl2,所选试剂为Na2CO3溶液,⑤的作用是除去过量的NaOH、Na2CO3,应选用盐酸,⑥的作用是从NaCl溶液中得到化学纯NaCl,为蒸发操作。
(2)BaCl2、NaOH、Na2CO3反应后得到的沉淀共有:泥沙、BaSO4、BaCO3、CaCO3、Mg(OH)2。
(3)第⑤步加入HCl,与NaOH和Na2CO3反应,所以离子方程式为:H+?+ OH- = H2O;? CO32- + 2H+ = H2O + CO2↑。
(4)HCl足量时第⑤步达到了目的,可用pH试纸检验,若试纸变化,证明HCl过量,OH?、CO32?不存在,若变蓝,说明还有OH?、CO32?,需继续滴加盐酸至呈酸性。
(5)NaOH不影响其他物质的除去,所以NaOH的加入顺序可以提前,也可以向后调整,即②和③或③和④可调换。
(6)用Ba (OH)2代替BaCl2和NaOH,可同时除去Na2SO4和MgCl2,使②③步合并为一步。
本题难度:一般
2、选择题 2007年世界十大科技新闻之一是“中国成功发射嫦娥一号卫星”。将来科学家要在月球上进行科学研究,下列实验操作中在月球表面难以完成的是[???? ]
A.蒸馏
B.溶解
C.过滤
D.蒸发
参考答案:C
本题解析:
本题难度:简单
3、填空题 (7分)在学校的联欢晚会上,老师做了神奇的表演,向装有不同固体的试管中滴入适量不同的无色液体,产生了不同的现象。老师让同学们参与互动进行猜想:
(1)若固体为白色粉末,加液体后产生了能使澄清石灰水变浑浊的气体.则固体可能是(任写一种,下同)????????????CaCO3,液体可能是??????????????。
(2)若固体为白色粉末,加液体后无气体产生,所得液体温度降低.则固体可能是???????NH4NO3,液体可能是???????????。
(3)若固体为黑色粉末,加液体后有气体产生,则黑色粉末可能是?????????????,反应的化学方程式为???????????????????????????????????。
参考答案:(1)CaCO3??盐酸??(2)NH4NO3?? H2O?
本题解析:(1)能使澄清石灰水变浑浊的气体一般是CO2,所以固体可能是碳酸钙,液体是盐酸。
(2)所得液体温度降低,说明固体溶于水吸热,因此固体是硝酸铵,液体是水。
(3)黑色固体和液体反应生成的应该是氧气,即双氧水在催化剂的作用下分解产生氧气,方程式为2H2O2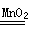 2H2O+O2↑。
2H2O+O2↑。
本题难度:一般
4、选择题 下列所采取的分离方法正确的是
[ ??? ]
A.由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
B.水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精
C.可用冷却热的饱和氯化钾和氯化钠溶液的方法得到纯净的氯化钠晶体
D.通过灼热的CuO粉末除去CO2中少量的CO
参考答案:D
本题解析:
本题难度:一般
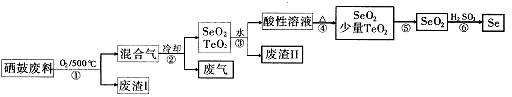
5、简答题 (14分)硒34Se和碲52Te都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上用硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
已知:
(1)Se的氢化物的电子式是____。
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是??????????。
(3)废气的主要成分是____???;废渣II的主要成分是????????????。
(4)步骤④中主要反应的化学方程式是???????;步骤⑥反应的化学方程式是??????????。
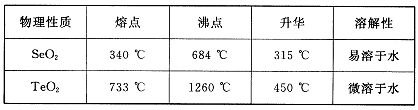
(5)根据表中数据,步骤⑤最适宜的分离方法是?????????????。
参考答案:(14分)
(1) 本题解析:
本题解析:
试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为 ;
;
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华。
本题难度:一般