微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为了比较氯和碘单质氧化性的强弱,可先制取氯气,并将氯气通入碘化钾淀粉溶液中,下图是本实验所需的仪器和药品。图中A、B、C、D、E、F分别表示玻璃导管或仪器接口。
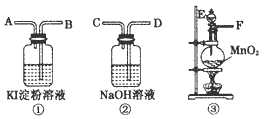
请回答下列问题:
(1)气体流向从左到右。实验前,上述各仪器装置的正确连接顺序是(填各接口的字母符号):分液漏斗从E处插入烧瓶后,____接____接____接____。
(2)写出制备Cl2的反应方程式___。某学生用含 0.4 mol HCl的浓盐酸和足量MnO2反应制Cl2,但得到的 Cl2总小于2.24 L(标准状况下),为什么?______ 。
(3)实验完成后,装置①中的溶液为____色,再向其中滴加足量NaOH溶液颜色能否褪去?____(填“能”或 “不能”),装置②中NaOH溶液的作用是_______。
(4)工业上,可用Cl2制备漂白粉,请写出制备漂白粉的离子方程式:____。
参考答案:(1)F ;B ;A ;D
(2)MnO2+4HCl
本题解析:
本题难度:一般
2、实验题 (8分)配制一定 物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
物质的量浓度的NaOH溶液时,下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
(1)、用纸片连称量NaOH固体。? ____________;
(2)、向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施。_________;
(3)有少量NaOH溶液残留在烧杯内。____________;
(4)向容量瓶加水时眼睛一直俯视液面。____________。
参考答案:(8分) (2分/空)(1)偏低( 本题解析:略
本题解析:略
本题难度:一般
3、简答题 某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如图所示.

已知:各离子开始沉淀及完全沉淀时的pH如下表所示.
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH
Fe2+
6.34
9.7
Fe3+
1.48
3.2
Zn2+
6.2
8.0
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)______?Ksp(ZnS)(选填“>”“<”或“=”).
(2)物质A可使用下列物质中的______.
A.KMnO4?????B.O2??????C.H2O2??????D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在______范围之间.
(4)物质B可直接用作氮肥,则B的化学式是______.
(5)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂--K2FeO4,写出该反应的离子方程式______.
参考答案:(1)相同条件下,溶解度大的物质先溶解,因在H2SO4的作用
本题解析:
本题难度:一般
4、实验题 为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如下图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,实验装置从左至右的连接顺序为:
装置②→ → → ;
(2)装置②中主要玻璃仪器的名称___________、___________、___________;
(3)实验室制备Cl2的离子方程式为________________________________;
(4)装置③中Cu的作用 (用化学方程式表示);
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置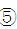 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置 ,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置 应放入 。 应放入 。
(6)实验结束,处理多余Cl2的常用试剂是______________,有关反应的离子方程式为______________________________________________。
(7)实验用的AgNO3需配制,下列情况会使所配溶液浓度偏高的是(填序号) ____。

a.某同学观察液面的情况如图所示
b.没进对烧杯、玻璃棒进行洗涤操作
c.定容时,不慎超过了刻度线
d.AgNO3固体称量时,砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
参考答案:(1) ②→ ④→ ③→ ①;⑵?分液漏斗 , 酒精灯??,
本题解析:
试题分析:(1)②为气体的制备装置,④为干燥装置,③为除去氯气的装置,①为证明气体中混有HCl;(3)实验室制取氯气的化学方程式为MnO2 +4HCl=MnCl2+Cl2↑+2H2O(4)混有HCl的Cl2经过灼热的铜单质,Cl2与Cu发生氧化还原反应;(5)若气体进入①装置时含有Cl2,因Cl2+2H2O=HCl+HClO,①装置同样有白色沉淀产生,故不能证明气体中混有HCl;加装置⑤,若湿的碘化钾淀粉试纸不变色,则证明进入①装置中的气体为HCl。(7)所配溶液浓度增高,只有两种情况,一是溶剂加少了,如a;二是溶质加多了,如d。b、c是浓度偏低,而e是没有影响。
点评:对化学实验的考查是历年高考重点,考生在备考过程中应注意对化学实验的相关知识的积累,尤其是课本中涉及的制备实验,应多加关注。
本题难度:一般
5、实验题 某铝合金中含有合金元素镁、铜、硅,为了测定该合金中铝的含量,设计如下实验方案,请回答有关问题:
(1)称取样品a g,称量时应该使用的仪器名称是_________。
(2)将样品溶于足量的稀盐酸,过滤,溶液中主要含有________,滤渣中含有_______。
(3)滤液中加入过量的NaOH溶液,过滤。所得滤渣的化学式为_________。
(4)往步骤(3)的滤液中通入足量的CO2气体,过滤。反应的离子方程式为_________。
(5)步骤(4)过滤所得的滤渣用蒸馏水洗涤3次,烘干后高温灼烧至质量不再减轻为止,称得其质量为b g,则原样品中铝的质量分数为_________(用a、b表示)。
参考答案:(1)托盘天平(1分)?(2)MgCl2、AlCl3? Cu
本题解析:由题意可知,用托盘天平称取的a g样品在实验操作中完成了如下转换关系:

所以样品中Al的质量分数为:
 ×100%= ×100%=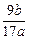 ×100% ×100%
本题难度:一般
|