微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 短周期元素?X?和?Y?可以形成?XY4?型化合物,若?X?的原子序数为?m,Y?的原子序数为?n,则?m?和n?的相互关系不可能是( )
A.m-13=n
B.n+5=m
C.n-11=m
D.m+8=n
参考答案:短周期元素X和Y可以形成XY4型化合物,则X为第ⅣA族元素、
本题解析:
本题难度:简单
2、选择题 下列化学用语表达正确的是( )
A.丙烯的结构简式:CH3CH2CH2
B.Mg原子结构示意图:
C.乙酸的分子比例模型图为: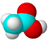
D.次氯酸的结构式为:H-Cl-O
参考答案:A.丙烯的结构简式为:CH3CH=CH2,故A错误;
本题解析:
本题难度:一般
3、选择题 下列物质中,属于含有共价键的离子化合物的是( )
A.KOH
B.Br2
C.MgCl2
D.H2S
参考答案:A
本题解析:
本题难度:简单
4、填空题 (12分)A、B、C、D、E、F、G七种前四周期元素,其原子序数依次增大。A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D及其同主族元素的氢化物沸点变化趋势如图;F是地壳中含量最高的金属元素;G与F同主族。请回答下列问题:
(1)写出F元素基态原子的核外电子排布式??????????????;
(2)B、C、D三种元素电负性由大到小的顺序是????????????????(用元素符号表示);
(3)下列有关上述元素的说法,正确的是???????????(填序号);
①CA3沸点高于BA4,主要是因为前者相对分子质量较大
②Ni(BD)4常温下为液态,易溶于CCl4、苯等有机溶剂,因此固态Ni(BD)4属于离子晶体
③C的氢化物的中心原子采取sp2杂化
④F单质的熔点高于E单质,是因为F单质的金属键较强
⑤比G的原子序数少1的元素第一电离能高于G
(4)CA3分子的空间构型为???????????,1 mol B2A4分子中含有?????????molσ键;
(5)ED是优良的耐高温材料,其晶体结构与NaCl晶体相似。ED的熔点比NaCl高,其原因是???????????????????????????????????????????。
说明:O摄氏度=273K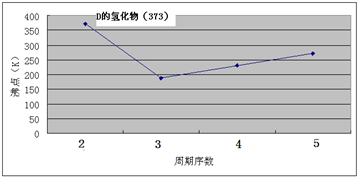
参考答案:(1)1S22S22P63S23P1????????(2)O
本题解析:原子中没有成对电子只有氢元素,即A是H。基态原子中电子占据三种能量不同的原子轨道,说明这三种轨道分别是1s、2s和2p,又因为每种轨道中的电子总数相同,所以B是C。根据氢化物沸点变化趋势如图可判断,氢化物形成的晶体是分子晶体,但D的最高,沸点是100℃,说明氢化物中含有氢键,且D位于第二周期,故D是O。地壳中含量最高的金属元素是Al,即F是Al。G与F同主族,G的原子序数最大,则G是Ga。由于A、B、C
本题难度:一般
5、填空题 (8分).(1)利用VSEPR推断分子或离子的空间构型。PO???;CS2?????;AlBr3(共价分子)????????。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
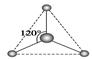 __________;
__________;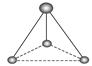 __________。
__________。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
参考答案:(1)四面体形 直线形 平面三角形 (2)CH3— CH3—
本题解析:(1)三种微粒中中心原子含有的孤对电子对数分别是(5+3-2×4)÷2=0、(4-2×2)÷2=0、(3-1×3)÷2=0,所以空间构形分别是四面体形、直线形、平面三角形。
(2)根据模型可知,第一种是平面三角形,第二种是三角锥形。所以前者没有孤对电子,后者含有一对孤对电子,所以化学式分别是CH、CH。
(3)第二周期非金属元素构成平面三角形分子的是BF3;三角锥形的是NF3;四面体型的是CF4。
本题难度:一般