微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分) 氯气在生产生活中应用广泛。
(1)工业上可用MnSO4溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的化学方程式 。
(2)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2 。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
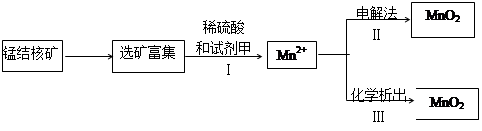
①步骤I中,试剂甲必须具有的性质是 (填序号)。
a. 氧化性 b.还原性 c.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL ,该反应的离子方程式为________________。
参考答案:(1) 2MnSO4+Cl2+3H2O="=" Mn2O3+
本题解析:
试题分析:(1) 氯气与MnSO4溶液反应,氯气作为氧化剂,MnSO4被氧化为Mn2O3,方程式为:2MnSO4+Cl2+3H2O="=" Mn2O3+2H2SO4+2HCl;
(2)MnO2具有强氧化性,转化为锰离子,说明加入的物质具有还原性;当把锰离子转化为二氧化锰,生成0.050 mol MnO2,失去0.1mol电子,消耗0.020 molNaClO3,得到0.1mol电子,则1个NaClO3得到5个电子,即1个Cl降低5价,生成的应该是Cl2,反应如下:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+。
考点:考查氧化还原反应方程式书写及计算。
点评:根据题给信息书写氧化还原反应方程式是学生的难点,本题难度较大。
本题难度:困难
2、选择题 由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性溶液中可以产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA
B.该混盐的水溶液显碱性
C.该混盐中氯元素的化合价为+1和-1价
D.该混盐具有较强的还原性
参考答案:D
本题解析:
试题分析:混盐CaOCl2在酸性条件下可以产生Cl2,应为CaCl2和Ca(ClO)2的混合物;A、该反应的离子方程式为Cl-+ClO-+2H+=Cl2+H2O,产生1molCl2时转移NA个电子,正确;B、Ca(ClO)2为强碱弱酸盐水解呈碱性,正确; C、Ca(ClO)2中Cl元素化合价为+1价,CaCl2Cl元素化合价为-1价,正确;D、Ca(ClO)2中Cl元素化合价为+1价,具有强氧化性,错误。
本题难度:一般
3、选择题 ClO2遇浓盐酸会生成Cl2,反应方程式为2ClO2+8HCl====5Cl2+4H2O,该反应中若转移电子的数目为9.632×1023,则产生的Cl2在标准状况下的体积为 ( )
A.11.2 L
B.33.6 L
C.22.4 L
D.44.8 L
参考答案:C
本题解析:
试题分析: n(e-)=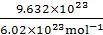 =1.6 mol。因为2ClO2~Cl2~8e-,8HCl~4Cl2~8e-,所以该反应转移的电子数为8e-,即5Cl2~8e-,所以n(Cl2)=
=1.6 mol。因为2ClO2~Cl2~8e-,8HCl~4Cl2~8e-,所以该反应转移的电子数为8e-,即5Cl2~8e-,所以n(Cl2)= n(e-)=
n(e-)= ×1.6 mol="1" mol,V(Cl2)="1" mol×22.4 L·mol-1=22.4 L。
×1.6 mol="1" mol,V(Cl2)="1" mol×22.4 L·mol-1=22.4 L。
考点:氧化还原反应
本题难度:一般
4、选择题 下列有关化学用语表示正确的是
A.CO2的分子比例模型:
B.质量数为37的氯原子:
C.Mg2+结构示意图:
D.NH4Cl的电子式:
参考答案:C
本题解析:
试题分析:A、二氧化碳是直线形分子,其比例模型是 ,A不正确;B、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,因此质量数为37的氯原子:
,A不正确;B、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,因此质量数为37的氯原子: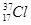 本题难度:简单
本题难度:简单
5、选择题 下列化学用语表达正确的是? (??? )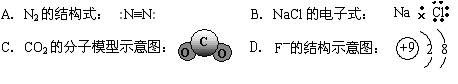
参考答案:D
本题解析:N2的结构式:N  N;B:氯化钠应该是钠离子与氯离子形成的离子键;CO2分子是直线型。
N;B:氯化钠应该是钠离子与氯离子形成的离子键;CO2分子是直线型。
本题难度:简单