微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将4molA气体和2molB气体在2L的密闭容器内混合,并在一定条件下发生如下反应:2A(g)+B(g)?2C(g),若经2s后测得C的浓度为0.6mol?L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol?L-1?s-1
②用物质B表示的反应的平均速率为0.6mol?L-1?s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7mol?L-1
其中正确的是( )
A.①③
B.①④?
C.②③
D.③④
参考答案:利用三段式法计算:
起始A的浓度为
本题解析:
本题难度:简单
2、填空题 (4分)将固体NH4I置于密闭容器中,某温度下发生下列变化:
NH4I(s) 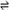 ?NH3 (g) + HI(g)??????? 2HI(g)
?NH3 (g) + HI(g)??????? 2HI(g) 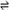 ?H2(g) + I2(g)
?H2(g) + I2(g)
当反应达到平衡时c (H2)=" 0.5" mol/L, c (HI)=" 4" mol/L, 则 c(NH3)??????,HI 的
分解率为???????。
参考答案:(4分)? 5 mol/L ;20%
本题解析:略
本题难度:简单
3、选择题 可逆反应 CO(g) + H2O(g) 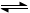 CO2(g) + H2(g), 在密闭容器达到平衡。 当温度为749K时,K= 1,当CO的起始浓度仍为2 mol·L-1, H2O的起始浓度为6mol·L-1时,则CO的转化率为(??? )
CO2(g) + H2(g), 在密闭容器达到平衡。 当温度为749K时,K= 1,当CO的起始浓度仍为2 mol·L-1, H2O的起始浓度为6mol·L-1时,则CO的转化率为(??? )
A.80%
B.75%
C.50%
D.25%
参考答案:B
本题解析:CO(g) + H2O(g) 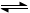 CO2(g) + H2(g)
CO2(g) + H2(g)
初c:?? 2?????? 6????????? 0?????? 0
平c:?? 2—x? 6—x????????? x????? x
则:(2—x)(6—x)=x2??,解得x=1.5,故CO的转化率为75%
本题难度:一般
4、选择题 可逆反应:A2(?)+B2(?) 2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是
2AB(?);ΔH=-QkJ/mol,当温度和压强改变时n(AB)的变化如下图,下列叙述正确的是

A. A2、B2及AB均为气体,Q>0
B.AB为气体,A2、B2至少有一种为非气体,Q>0
C.AB为气体,A2、B2有一种为非气体,Q<0
D.AB为固体,A2、B2有一种为非气体,Q>0
参考答案:B
本题解析:根据图像可知,温度越高,物质AB的物质的量减少,这说明升高温度,平衡向逆反应方向进行,即正反应是放热反应,使用Q大于0;增大压强时物质AB的物质的量也减少,这说明增大压强,平衡向逆反应方向进行,因此正反应是体积增大的,所以AB一定是气体,而反应物A2、B2中至少有一种为非气体,所以答案选B。
本题难度:一般
5、填空题 (10分)在密闭容器中进行可逆反应:
CO(气)+NO2(气) ?CO2(气)+NO(气)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:
?CO2(气)+NO(气)△H<0,达到平衡后,只改变其中一个条件,对平衡的影响是:
(1)增大容器的体积,平衡 ,反应混合物的颜色 。
(2)通人CO2气体,平衡 ,反应混合物的颜色 。
(3)加入催化剂,平衡 。
参考答案:(1)不移动?变浅(2)左移??变深(3)不移动
本题解析:根据方程式可知,该反应是体积不变的、放热的可逆反应,则
(1)增大容器的体积,物质的浓度降低,但平衡不移动。浓度降低,颜色变浅。
(2)增大CO2的浓度,即增大生成物的浓度,平衡向逆反应方向移动,NO2的浓度增大,颜色加深。
(3)催化剂只能影响反应速率,但不能改变平衡状态,因此平衡不移动。
本题难度:一般