微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是??????????????????。
(2)C、N、O三种元素第一电离能从大到小的顺序是??????????。
(3)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是???????????。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(1)+2N2H4(l)=3N2(g)+4H2O(g)△H=" —103" 8.7kJ.mol—1
若该反应中有4mol N—H键断裂,则形成的 键有?????????mol。
键有?????????mol。
③肼能与硫酸反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在?????(填标号)
a.离子键? b.共价键? c.配位键? d.范德华力
(4)氮化硼(BN)是一种重要的功能陶瓷材料,在与石墨结构相似的六方氮化硼晶钵中,层内B原子与N原子之间的化学键为___????????。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为3.615×l0—10m,立方氮化硼晶胞中含有?????个氮原子、?????个硼原子,立方氮化硼的密度是?????g.cm一3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
参考答案:(1)2s22p3(2分)
(2)N>O>C(2分)<
本题解析:
试题分析:(1)根据构造原理可写出基态氮原子的价电子排布式是2s22p3。
(2)非金属性越强,第一电离能越大。但由于N中的2p是半充满,稳定性强,所以第一电离能大于O的,顺序为N>O>C。
(3)①NH3分子中中心原子含有1对孤对电子,所以是三角锥形结构。NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。
本题难度:一般
2、填空题 (13分)试根据上表填空:
A
| ?
| ?
|
?
| B
| ?
| ?
| C
| D
| E
| F
| ?
|
G
| H
| I
| J
| ?
| L
| K
| M
|
?
| ?
| ?
| ?
| ?
| ?
| ?
| N
| ?
| ?
| Q
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
| | | | | | | | | | | | | | | | | |
|
(1)请写出元素Q的基态原子电子排布式?????????????????????????;元素N在周期表中的位置????????周期?????????族。
(2)基态D原子核外有????个未成对电子;D2分子中分别有?????个,??????个π键。
(3)化合物DA5中既含离子键,又含共价键和配位键,请写出它的电子式?????。
(4)表四中的元素能形成XY2型的共价分子有CE2、CL2、BK2、LE2四种,其分子的空间构型中有一种与其他三种不同,它是????????(填化学式);而形成XY3型的共价分子也有四种,它们分别是DA3、DF3、DK3、LE3,其分子的空间构型中也有一种与其他三种不同,它是??????????(填化学式),它是由_???????键(填“极性”或“非极性”,下同)构成的???????????分子。
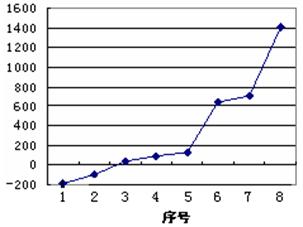
(5)第三周期8种元素按单质熔点高低的顺序如右图所示,其中序号“8”所代表的元素是??????????(填元素符号);其中气态氢化物稳定性最强的元素是??????????(填下图中的序号)。
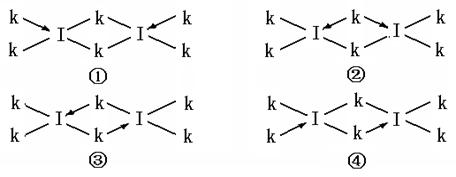
(6)科学家证实,IK3属于共价化合物,分子式为I2K6,其结构式为下列四种中的一种,你认为正确的结构式是____________。
(7)向Q的硫酸盐溶液中加入足量的DA3的水溶液过程中,请写出发生反应的离子方程式????????????????????????????????????????????????????;最后生成配离子的结构式为?????????????????????????。
参考答案:(1)(2分)1s22s22p63s23p63d104s1;
本题解析:(1)Q是铜,根据构造原理可知,电子排布式为1s22s22p63s23p63d104s1。N是铁元素,位于第4周期VIII族。
(2)D是氮元素,最外层有3个未成对电子。氮气是由三键构成的,而三键是由2个π键和1个σ键构成。
(3)化合物DA5是氢化铵,属于离子化合物。电子式为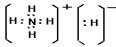 。
。
(4)CE2
本题难度:一般
3、选择题 下列物质中含有非极性键的分子是( )
A.Na2O2
B.CH4
C.N2
D.CO2
参考答案:C
本题解析:
本题难度:一般
4、填空题 (8分,每空2分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)写出与H2O分子互为等电子体的微粒___??????___(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+)。下列对上述过程的描述不合理的是??? ( )
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
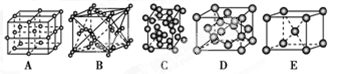
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是________(请用相应的编号填写)。
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如下图所示),已知冰的升华热是51 kg/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_____??? ___kJ/mol;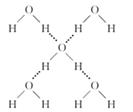
参考答案:(1)H2S?(2)A?(3)BC??(4)20
本题解析:(1)分子数和价电子数分别都相等的是等电子体,所以和水互为等电子体的是H2S。
(2)水是V型结构,而H3O+是三角锥形,氧原子还是sp3杂化,选项A是错误的,其余都是正确的,答案选A。
(3)根据晶胞结构可知,A~E分别是氯化钠、CO2、碘、金刚石和钠。由于水形成的晶体是分子晶体,所以答案选BC。
(4)根据结构可知,每个水分子形成2个氢键,所以氢键键能是(51 kg/mol-11 kg/mol)÷2=20 kg/mol。
本题难度:一般
5、选择题 易与1939X反应,形成离子化合物的是( )
A.1021Y
B.1123Z
C.1224L
D.919M
参考答案:D
本题解析:
本题难度:一般