微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4
参考答案:
本题解析:
本题难度:一般
2、选择题 A、B、C、D都是含碳、氢、氧的单官能团化合物,A水解得B和C,B氧化可以得到C或D,D氧化也得到C。若M(X)表示X的摩尔质量,则下式中正确的是
A.M(A)="M(B)+M(C)"
B.2M(D)= M(B)+M(C)
C.M(B)< M(D)<M(C)
D.M(D)<M(B)
参考答案:D
本题解析:考查官能团的转化。A是酯类,所以M(A)+18="M(B)+M(C)" ,选项A不正确;B是醇,D是醛,C是羧酸,且都含有相同的碳原子数,所以选项BC都是错误的,选项D正确,答案选D。
本题难度:困难
3、选择题 50ml 18.4mol/L硫酸与足量的铜片加热反应,被还原的硫酸的物质的量是
A.0.92mol
B.大于0.46mol, 小于0.92mol
C.0.46mol
D.小于0.46mol
参考答案:D
本题解析:
试题分析:根据铜和浓硫酸反应的方程式:Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑,铜只与浓硫酸反应,随着反应进行,浓硫酸的浓度会逐渐降低,而稀硫酸不能氧化铜,反应停止。浓硫酸的物质的量是0.05L×18.4mol/L=0.92mol,根据反应式理论上被还原的硫酸是0.46mol,所以实际上被还原的硫酸小于0.46mol。
CuSO4+2H2O+SO2↑,铜只与浓硫酸反应,随着反应进行,浓硫酸的浓度会逐渐降低,而稀硫酸不能氧化铜,反应停止。浓硫酸的物质的量是0.05L×18.4mol/L=0.92mol,根据反应式理论上被还原的硫酸是0.46mol,所以实际上被还原的硫酸小于0.46mol。
考点:考查浓硫酸的性质及计算。
本题难度:一般
4、填空题 (10分)海藻中含有丰富的、以离子形式存在的碘元素.如图是实验室从海藻里提取碘的流程的一部分。
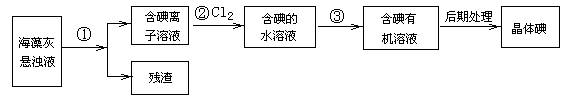
回答下列问题:
(1)步骤①、③的操作分别是 。
(2)步骤②的离子反应方程式: 。步骤②中Cl2应 (填少量或适量或过量)。
(3)在步骤②中若不用Cl2,则下列氧化剂中最好选用(填代号): 。
A.浓硫酸
B.新制氯水
C.高锰酸钾溶液
D.双氧水
(4)步骤③中应加入的有机溶剂是 ,而不能用 等有机溶剂。
(5)能否用淀粉溶液检验步骤②的反应有否进行完全 (填能或否),其理由是: 。
参考答案:(共10分,每小题2分)(1)过滤、萃取 (2)C
本题解析:
试题分析:(1)步骤①将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法,将碘水转化为含碘的有机溶液,步骤③需用对卤素单质溶解能力强的有机溶剂把碘从碘水中提取出来,对应进行的实验操作是萃取,故答案为:过滤;萃取;
(2)氯气可将碘离子氧化为碘单质,反应的离子方程式为2I-+Cl2=2Cl-+I2;氯气过量时,过量氯气能氧化碘单质,生成碘酸,5Cl2+I2+6H2O=2HIO3+10HCl,所以需适量,故答案为:2I-+Cl2=2Cl-+I2;适量;
(3)步骤④的目的是碘离子在酸性条件下可被氧化生成单质碘,除此之外选择的氧化剂最好是过氧化氢,不引入新的杂质;A.浓硫酸引入硫酸根离子,故A不符合;B.新制氯水会引入氯离子,故B不符合;C.KMnO4溶液会引入钾离子等,故C不符合;D.H2O2 做氧化剂被还原为水,不引入新的杂质,故D符合;故答案为:D;
(4)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,酒精、乙酸和水互溶,不能用作萃取剂,四氯化碳与水互不相容,故可用四氯化碳,故答案为:CCl4,酒精或乙酸等;
(5)碘遇淀粉变蓝色,碘离子和淀粉不反应,所以淀粉能检验碘单质的存在不能检验碘离子,故答案为:否;因为碘遇淀粉变蓝色,碘离子和淀粉不反应,所以淀粉能检验碘单质的存在不能检验碘离子。
考点:本题以实验室从海藻里提取碘为载体考查了混合物分离的方法、碘的性质、萃取剂的选取等
本题难度:一般
5、选择题 苹果汁中含有Fe2+,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生。这说明维生素C有
A.还原性
B.氧化性
C.碱性
D.酸性
参考答案:A
本题解析:
试题分析:依题意,维生素C将Fe3+还原为Fe2+,铁元素由+3价降为+2价,被还原,则Fe3+是氧化剂,维生素C是还原剂,表现还原性,A项正确。
考点:考查阿伏伽德罗常数、气体体积等相关知识。
本题难度:一般