微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25 ℃、101 k Pa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是(??)。
Pa下,石墨、金刚石燃烧的化学方程式分别为:C(石墨) + O2(g) = CO2(g),1 moL C(石墨) 完全燃烧放热393.51 kJ;C(金刚石) + O2(g) = CO2(g),1 moL C(金刚石) 完全燃烧放热 395.41 kJ。据此推理所得到的下列结论中,正确的是(??)。
A.金刚石比石墨稳定
B.由石墨制备金刚石一定是吸热反应
C.石墨的能量比金刚石的能量高
D.石墨转化为金刚石是物理变化
参考答案:B
本题解析:略
本题难度:简单
2、填空题 白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s)? ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+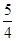 O2(g)===
O2(g)=== P4O10(s)? ΔH2=-738.5 kJ·mol-1
P4O10(s)? ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为???????????????。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s)? ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为???????,反应过程中放出的热量为???????。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
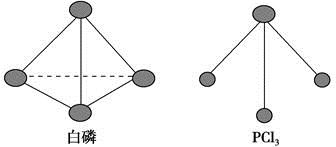
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH=???????。
参考答案:(1)P4(s,白磷)===4P(s,红磷)? ΔH=-29
本题解析:(1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(s,白磷)===4P(s,红磷) ΔH=-2983.2 kJ·mol-1-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。
(2)n(白磷)=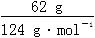 =0.5 mol,n(O2)=
=0.5 mol,n(O2)= 本题难度:一般
本题难度:一般
3、选择题 铁和稀硫酸在敞口容器中进行反应: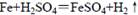 ,下列叙述中不正确的是
,下列叙述中不正确的是
A.该反应的反应过程与能量关系可以用下图表示

B.若将该反应设计成原电池,当正极产生22.4L气体时,有56g铁溶解
C.若将该反应设计成原电池,溶液中SO42-向Fe电极移动
D.若将该反应设计成原电池,负极发生的反应是:Fe -2e =Fe2+
参考答案:B
本题解析:
试题分析: A、金属和稀硫酸是放热反应,正确;B、有56g铁溶解,正极产生标准状况下22.4L气体,错误;C、原电池中,阴离子移向负极,正确;D、铁做负极,发生的反应是:Fe -2e =Fe2+,正确。
本题难度:一般
4、实验题 (2014届河南省中原名校高三下学期第一次联考化学试卷)
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2? 21℃、NO?-152℃

(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?? △H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?? △H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
参考答案:
(1)E D B(2分);检验装置的气密性(1分)?
本题解析:
本题是实验题。实验题是同学们的难点。也是最难得分的题型。对于实验题,首先需看清楚实验目的是什么。在结合看清实验流程,实验操作,物质检验等知识会穿插其中。这题是一道实验探究题,探究NaNO2与H2SO4的反应。从所给装置中,A显然是发生装置。B是NaOH溶液,可能是除杂装置,C是浓硫酸,显然是干燥装置。D是热水浴,并通入了O2,需要通O2检验的是NO气体。E是冷水浴装置。显然是冷却物质。由题中所给2个信息,第一个信息是NO与NO2的混合气体与NaOH发生归中反应。第二个信息是NO、NO2两种气体的物
本题难度:一般
5、选择题 下列反应既是非氧化还原反应又是吸热反应的是
A.钠放在水中,四处游动
B.生灰石与水反应
C.高温煅烧石灰石
D.在稀硫酸中滴加氢氧化钠溶液
参考答案:C
本题解析:
试题分析:生石灰与水反应,高温煅烧石灰石,稀硫酸与氢氧化钠反应中没有化合价的变化,所以不属于氧化还原反应。生石灰与水反应,稀硫酸与氢氧化钠反应属于放热反应,高温煅烧石灰石属于吸热反应。答案选C。
点评:常见的吸热反应:一般的分解反应,一般的高温反应,C和CO2反应,NH4Cl和Ba(OH)2·H2O。常见的放热反应:中和反应,燃烧反应,一般的化合反应,金属与水或酸反应。
本题难度:一般