微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (15分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图9。
已知:Na2S2O3 在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图10所示。

(1)Na2S2O3·5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式:???。
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH?????时,打开K2、关闭K1并停止加热,理由是???。装置B、D的作用是???。
步骤3:过滤C中的混合液,将滤液经过???、???、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由???。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为①Cr2O72-+ 6I-+ 14H+??2Cr3++3I2+7H2O;②I2+ 2S2O32-?2I-+ S4O62-。
则该废水中Ba2+的物质的量浓度为???。
实验题 (15分)硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图9。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图10所示。

(1)Na2S2O3·5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式:???。
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH?????时,打开K2、关闭K1并停止加热,理由是???。装置B、D的作用是???。
步骤3:过滤C中的混合液,将滤液经过???、???、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由???。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为①Cr2O72-+ 6I-+ 14H+??2Cr3++3I2+7H2O;②I2+ 2S2O32-?2I-+ S4O62-。
则该废水中Ba2+的物质的量浓度为???。
本题答案:(15分)
(1)Cu + 2H2SO4(浓) 本题解析:(1)步骤1:铜在加热的条件下可还原浓硫酸,生成SO2:Cu + 2H2SO4(浓) 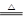 CuSO4 + 2H2O + SO2↑
CuSO4 + 2H2O + SO2↑
步骤2:SO2+S+Na2CO3=Na2S2O3+CO2,由于Na2S2O3在酸性溶液中不能稳定存在,原溶液水解呈碱性,随着SO2的通入,碱性逐渐减弱,当pH接近7时,停止停止通入气体燕停止加热
B、D装置均是为了吸收SO2,防止污染
步骤3:Na2S2O3的溶解度随温度降低而迅速减小, Na2CO3的溶解度随温度变化较小,故为了得到Na2S2O3,可蒸发浓缩、冷却结晶,再过滤、洗涤、干燥制取产品
(2)由于氯水中含有Cl-:Cl2+H2O=H++Cl-+HClO,故向其中加入AgNO3溶液,氯水颜色变浅且有白色沉淀生成,并不能说明Na2S2O3还原了氯气,具有还原性
(3)由关系式Ba2+~BaCrO4~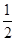 CrO42-~
CrO42-~ I2~3Na2S2O3可知,n(Ba2+)=
I2~3Na2S2O3可知,n(Ba2+)=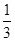 ×0.010×
×0.010× =0.0006mol,c(Ba2+)=2.4×10-3 mol·L-1
=0.0006mol,c(Ba2+)=2.4×10-3 mol·L-1
本题所属考点:【气体的净化、干燥、吸收与收集】
本题难易程度:【一般】
To wait for luck is the same thing as waiting for death. 等待走运无异于等待死亡.