微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):
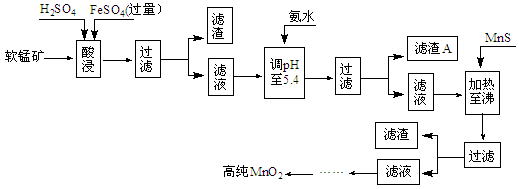
某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.8 6%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Cu(OH)2
| Zn(OH)2
|
pH
| 5.2
| 3.2
| 9.7
| 10.4
| 6.7
| 8.0
|
沉淀物
| CuS
| ZnS
| MnS
| FeS
| ?
| ?
|
Ksp
| 8.5×10-45
| 1.2×10-23
| 1.4×10-15
| 3.7×10-14
| ?
| ?
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子方程式为:
??????????????????????。
(2)滤渣A的主要成分为???????????????????。
(3)加入MnS的目的是除去???????????杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为???????????????。
(5)从废旧碱性锌锰电池中可回收利用的物质有????????????(写两种)。
填空题 (10分)二氧化锰是制造锌锰干电池的基本原料,普通锌锰干电池的电池反应式为:2MnO2+Zn+2H2O=2MnOOH+Zn(OH)2。工业上以软锰矿为原料,利用硫酸亚铁制备高纯度二氧化锰的流程如下(软锰矿中所有金属元素在酸性条件下均以阳离子形式存在):

某软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.24%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物形式完全沉淀时,溶液的pH及部分硫化物的Ksp(均为25℃时)见下表,回答下列问题:
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Cu(OH)2
| Zn(OH)2
| pH
| 5.2
| 3.2
| 9.7
| 10.4
| 6.7
| 8.0
| 沉淀物
| CuS
| ZnS
| MnS
| FeS
| ?
| ?
| Ksp
| 8.5×10-45
| 1.2×10-23
| 1.4×10-15
| 3.7×10-14
| ?
| ?
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子方程式为:
??????????????????????。
(2)滤渣A的主要成分为???????????????????。
(3)加入MnS的目的是除去???????????杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应式为???????????????。
(5)从废旧碱性锌锰电池中可回收利用的物质有????????????(写两种)。
本题答案:(1)MnO2+2Fe2++4H+=Mn2++2Fe3++2
本题解析:酸液中发生二氧化锰的氧化性氧化亚铁离子,PH<5.4滤渣A的主要成分为铁的沉淀和铝的沉淀。加入MnS的目的是除去铜离子和锌离子。KSP小生成,CuS、 ZnS沉淀。碱性锌锰电池中,锰做正极被还原MnO2+H2O+e-=MnOOH+OH-。从废旧碱性锌锰电池中可回收利用的物质有锌和二氧化锰。
本题所属考点:【气体的净化、干燥、吸收与收集】
本题难易程度:【一般】
No one is a fool always, every one sometimes. 没有终生的傻瓜,也没有终生不当傻瓜的人. |
|