微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a????????????????。
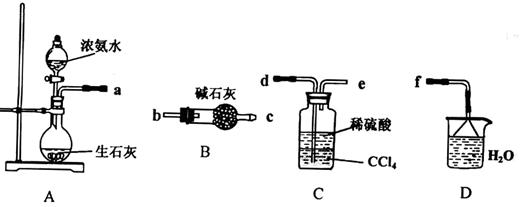
(2)将装置C中两种液体分离开的操作名称是___??__。装置D的作用是???????????????????????????。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
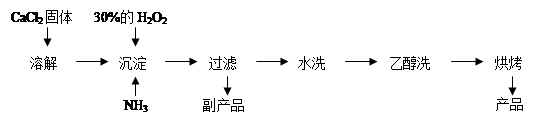
已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是???????????????????;
(2)检验“水洗”是否合格的方法是?????????????????????????????;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是:???????????????????????????? ??????。
②CaO2的质量分数为????????????????????(用字母表示);
实验题 Ⅰ.(1)某化学兴趣小组欲从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a????????????????。

(2)将装置C中两种液体分离开的操作名称是___??__。装置D的作用是???????????????????????????。
Ⅱ.过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:

已知CaO2·8H2O呈白色,微溶于水。I2+2S2O32-= 2I-+S4O62-
(1)用上述方法制取CaO2·8H2O的化学方程式是???????????????????;
(2)检验“水洗”是否合格的方法是?????????????????????????????;
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
①判断此滴定实验达到终点的方法是:??????????????????????????????????。
②CaO2的质量分数为????????????????????(用字母表示);
本题答案:Ⅰ(1)d e f???(2分)
(2) 分液(2分)
本题解析:
试题分析:Ⅰ(1)A装置制备氨气,因为和硫酸溶液反应,不需要干燥,C装置可以防倒吸,长进短出,D装置用来吸收多余的氨气。接口顺序d e f;(2)两种溶液互不相溶,用分液漏斗来分离,D装置吸收多余的NH3防止污染空气,防止倒吸;Ⅱ根据流程图可以推出原料,结合质量守恒原理可以推断出方程式CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl。水洗是为了除去沉淀表面的NH4Cl,最后检验氯离子即可,取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;(3)CaO2把KI氧化为I2,加淀粉溶液为蓝色,当Na2S2O3把I2反应完之后溶液变为 无色,所以滴定终点的判定是当滴入最后一滴标准溶液时溶液由蓝色变为无色(或溶液褪色),且半分钟不变色;②根据电子守恒CaO2---I2-----2Na2S2O3,建立关系,可以推出质量分数。
2
??????????? CV×10-3
本题所属考点:【气体的净化、干燥、吸收与收集】
本题难易程度:【一般】
A guilty conscience needs no accuser. 自己问心有愧,无需别人责备.