微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等元素的化合物杂质)为原料获得。有关工艺流程如下:
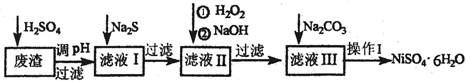
(1)往废渣中加H2SO4酸漫,要充分搅拌,其目的是???????????????????。
(2)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式????????????。
(3)加6%的H2O2时,温度不能过高,其目的是????????????????????????。
(4)除来源:91考试网 91eXAm.org铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,用NaClO3氧化Fe2+的离子方程式为???????????????????????????????????????。
(5)上述流程中滤液III的溶质的主要成分是:???????????????????。
(6)操作I包括以下过程:过滤,用H2SO4溶解,???????????????、??????????????、过滤、洗涤获得产品。
实验题 NiSO4?6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等元素的化合物杂质)为原料获得。有关工艺流程 如下:

(1)往废渣中加H2SO4酸漫,要充分搅拌,其目的是???????????????????。
(2)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式????????????。
(3)加6%的H2O2时,温度不能过高,其目的是????????????????????????。
(4)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,用NaClO3氧化Fe2+的离子方程式为???????????????????????????????????????。
(5)上述流程中滤液III的溶质的主要成分是:???????????????????。
(6)操作I包括以下过程:过滤,用H2SO4溶解,???????????????、??????????????、过滤、洗涤获得产品。
本题答案:(16分)(1)加快反应速率或提高浸出率(合理的给分)?(2
本题解析:
试题分析:(1)根据化学反应速率的影响因素及规律可知,充分搅拌的目的是加快废渣中的镍单质等与硫酸反应的速率,提高镍元素的浸出率;(2)Na2S是可溶性盐,溶于水时电离出S2ˉ,S2ˉ与Cu2+易反应生成CuS沉淀;(3)过氧化氢是绿色氧化剂,其目的是将Fe2+完全氧化为Fe3+,且不引入新的杂质,但是H2O2不稳定,受热易分解为水和氧气,因此温度不能过高;(4)NaClO3是可溶性盐,NaOH是强碱,根据题意可知,Fe2+是还原剂,ClO3ˉ是氧化剂,Fe3+是氧化产物,还原产物是Clˉ,而不是Cl2,因为碱性溶液不能大量存在Cl2,根据铁元素化合价升高总数等于氯元素化合价降低总数,电荷守恒、原子守恒原理可得反应式:6Fe2++ClO3ˉ+6H+=6Fe3++Clˉ+3H2O;(5)读图可知,加Na2S的目的是除去铜、锌等杂质,加H2O2、NaOH的目的是除去铁等杂质,加Na2CO3的目的是除去铬等杂质,因此推断滤液1的主要成分是NiSO4、FeSO4、Cr2(SO4)3、Na2SO4,滤液II的主要成分是NiSO4、Cr2(SO4)3、Na2SO4,滤液III的主要成分是NiSO4、Na2SO4;(6)从NiSO4、Na2SO4及硫酸的混合溶液中制取NiSO4?6H2O晶体,需要蒸发浓缩、冷却结晶、过滤、洗涤、干燥等过程。
本题所属考点:【气体的净化、干燥、吸收与收集】
本题难易程度:【一般】
Saying and doing are two things. 说与做是两回事.