微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象????、????。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是???????(写化学式)。
(3)采用重量法测定CuSO来源:91考试网4·5H2O的含量时,步骤如下:
①取样,称量????②加水溶解???③加氯化钡溶液生成沉淀??④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是???????????????????。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O CuSO4+5H2O
CuSO4+5H2O
b.CuSO4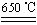 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是???(写化学式),其对应的物质的量之比是?????。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为???????g。
实验题 胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象????、????。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是???????(写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量????②加水溶解???③加氯化钡溶液生成沉淀??④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是???????????????????。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O CuSO4+5H2O
CuSO4+5H2O
b.CuSO4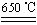 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是???(写化学式),其对应的物质的量之比是?????。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为???????g。
本题答案:Ⅰ.??(1)溶液呈蓝色、有红棕色气体产生????(2)Cu
本题解析:
试题分析:Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,溶液中存在氢离子和硝酸根离子,此时铜粉相当于和硝酸发生了反应,观察到的实验现象溶液呈蓝色、有红棕色气体产生。(2)由于制备中存在硝酸根,所以制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是)Cu(NO3)2。(3)要检验是否沉淀完全,可通过检验硫酸根离子是否含有,其操作是在上层清液中继续滴加氯化钡溶液,观察有无沉淀产生,若无,则沉淀完全。Ⅱ.(1)12.5克硫酸铜晶体(CuSO4·5H2O)是0.05mol,若只生成氧化铜,则为0.05mol(4g),不可能。若只生成氧化亚铜,则为0.025mol(3.6g),不可能;所以残留3.8 g固体为两者混合物。设氧化铜和氧化亚铜物质的量分别为x和y,则有x+2y=0.05,80x+144y=3.8。求得y:x=1:2。(2)三氧化硫和二氧化硫的生成量与铜的物质的量相同,即为0.05mol,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀是硫酸钡和亚硫酸钡,亚硫酸钡最终被氧化为硫酸钡,可知硫酸钡的物质的量为0.05mol,质量为)11.65g。
本题所属考点:【气体的净化、干燥、吸收与收集】
本题难易程度:【一般】
You should,like a candle,burn yourself out to give light to others. 要象蜡烛一样燃烧自已,照亮别人.