微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
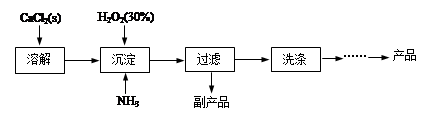

(1)用上述方法制取CaO2·8H2O的化学方程式是???????????????????。
(2)沉淀时常用冰水控制温度在10℃以下,其可能原因分别是???????????????????。
Ⅱ.过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为??????????。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
滴定次数
| 样品的质量/g
| KMnO4溶液的体积/mL
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 0.3000
| 1.02
| 24.04
|
2
| 0.3000
| 2.00
| 25.03
|
3
| 0.3000
| 0.20
| 23.24
???????????????????????????????????
填空题 (12分)过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
Ⅰ.过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下:
 
(1)用上述方法制取CaO2·8H2O的化学方程式是???????????????????。
(2)沉淀时常用冰水控制温度在10℃以下,其可能原因分别是???????????????????。
Ⅱ.过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200 mol·L—1KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+ =2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为??????????。
(4)根据表1数据,计算产品中CaO2·8H2O的质量分数(写出计算过程)
|