微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各物质中,不是按 (“→”表示一步完成)关系相互转化的是
(“→”表示一步完成)关系相互转化的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:根据物质的性质判断反应能否发生,C中SiO2不能与水反应生成H2SiO3.
解答:A.可发生:Fe FeCl3
FeCl3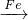 FeCl2
FeCl2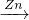 Fe,故A不选;
Fe,故A不选;
B.可发生:Cl2 NaClO
NaClO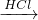 NaCl
NaCl Cl2,故B不选;
Cl2,故B不选;
C.SiO2不能与水反应生成H2SiO3,SiO2应先和碱反应生成Na2SiO3,然后再和酸反应生成H2SiO3,故C选;
D.可发生:HNO3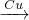 NO
NO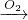 NO2
NO2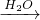 HNO3,故D不选.
HNO3,故D不选.
故选C.
点评:本题考查元素化合物知识,题目难度不大,本题注意把握常见元素化合物的性质.
本题难度:困难
2、选择题 对于反应2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O下列分析错误的是
A.该反应氧化剂是H2C2O4
B.反应中1mol?MnO4-得到5NA个e-
C.还原性Mn2+<H2C2O4
D.MnSO4可以做该反应的催化剂
参考答案:A
本题解析:分析:A.氧化还原反应中得电子化合价降低的反应物的氧化剂;
B.根据高锰酸根离子中锰元素和二价锰离子之间化合价的差来分析判断;
C.同一化学反应中,还原剂的还原性大于还原产物的还原性;
D.硫酸锰可以作催化剂.
解答:A.该反应中,C元素的化合价由+3价变为+4价,所以草酸是还原剂,故A错误;
B.反应中一个MnO4-得到(7-2)个e-,1molMnO4-得到5NA个e-,故B正确;
C.该反应中,草酸是还原剂,二价锰离子是还原产物,所以还原性Mn2+<H2C2O4,故C正确;
D.该反应中生成硫酸锰,硫酸锰能加快反应速率,所以可以做该反应的催化剂,故D正确;
故选A.
点评:本题考查氧化还原反应,注意草酸中碳元素化合价的判断方法,难度不大.
本题难度:简单
3、选择题 一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6g.当其缓慢通过无水CaCl2时,CaCl2质量增加了25.2g.原混合气体原混合气体中CO2质量为
A.12.5g
B.19.7g
C.13.2g
D.24.4g
参考答案:C
本题解析:分析:CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重25.2g为水的质量,根据H原子守恒可计算CH4的质量,根据C原子守恒可计算CO2的质量.根据C原子守恒可计算CO和CO2的总的物质的量,根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答:产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,
所以n(H2O)=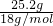 =1.4mol,
=1.4mol,
根据H原子守恒,可知:n(CH4)= n(H2O)=
n(H2O)= ×1.4mol=0.7mol,
×1.4mol=0.7mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,
所以m(CO)+m(CO2)=49.6g-25.2g=24.4g,
所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,
解之:n(CO2)=0.3mol,
所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g.
故选:C.
点评:本题考查混合物的计算,难度中的,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.
本题难度:困难
4、选择题 将几滴KSCN(SCN-是“类卤离子”,与氯离子性质相似)溶液加入酸性的含有Fe3+的溶液中,溶液变成血红色.将该红色溶液分为两份,①一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去.下列说法不正确的是
A.①红色褪去的原因可能是KMnO4将SCN-氧化,使[Fe(SCN)]2+消失
B.[Fe(SCN)]2+中Fe3+与SCN-以配位键结合
C.②红色褪去的原因是SO2具有漂白性
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
参考答案:C
本题解析:分析:A、根据高锰酸钾具有强氧化性,可以将SCN-氧化的原理来判断;
B、配位化合物中含有配位键;
C、二氧化硫能使品红褪色,根据漂白原理:适合有机色质的结合过程来回答;
D、高锰酸钾具有强氧化性,可以将还原性的离子氧化.
解答:A、三价铁离子遇到硫氰酸钾会发生络合反应:Fe3++2SCN-=[Fe(SCN)2]+,[Fe(SCN)]2+显红色,高锰酸钾具有强氧化性,可以将SCN-氧化,使[Fe(SCN)]2+的红色消失,故A正确;
B、[Fe(SCN)]2+属于配位化合物,[Fe(SCN)]2+中Fe3+与SCN-以配位键结合,故B正确;
C、二氧化硫只能漂白有机物,不能将Fe(SCN)]2+的红色漂白,故C错误;
D、高锰酸钾具有强氧化性,可以将SCN-氧化为(SCN)2,故D正确.
故选C.
点评:三价铁离子的检验以及高锰酸钾的氧化性知识是本题考查的重点,可以根据教材知识来回答,难度不大.
本题难度:一般
5、选择题 下列叙述正确的是
A.氧化还原反应的本质是化合价发生变化
B.在化学反应中得电子的物质氧化剂
C.还原剂在反应中发生还原反应
D.失电子越多,还原性越强
参考答案:B
本题解析:分析:A.氧化还原反应的本质为电子的转移;
B.在化学反应,氧化剂中元素的化合价降低;
C.还原剂在反应中被氧化;
D.失去电子的数目与还原性的强弱无关.
解答:A.氧化还原反应的本质为电子的转移,其特征为化合价的变化,故A错误;
B.在化学反应,氧化剂中元素的化合价降低,则得到电子,故B正确;
C.还原剂在反应中被氧化,发生氧化反应,故C错误;
D.失去电子的数目与还原性的强弱无关,还原性与失去电子的难易程度有关,故D错误;
故选B.
点评:本题考查氧化还原反应,明确氧化还原反应的实质、特征等,并熟悉氧化还原反应中的基本概念来解答,难度不大.
本题难度:困难