微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某厂废水中含量金属Cr3+(含有少量Fe3+、Cu2+)。某研究性学习小组为了变废为宝,将废水处理得到重铬酸钾。某含铬废水处理的主要流程如图所示:

已知:① 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
Fe(OH)3沉淀完全。
②CrO2—4在酸性环境中发生:
回答下列问题:
(1)滤渣的成分是????????。(写化学式)
(2)写出第③步反应的离子方程式???????????。
(3)分离出含[Cr(OH)4]—的溶液需要的玻璃仪器有?????????????。
(4)目前一种采用以铬酸钾为原料,电化学法制备重要铬酸钾的实验装置示意图如下:

电解一段时间后,测定阳极液中K元素和Cr元素的含量,若K元素与Cr元素的物质的量之比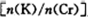 为d,则此时的铬酸钾的转化率为?????????。
为d,则此时的铬酸钾的转化率为?????????。
参考答案:(1)Cr(OH)3、Fe(OH)3、Cu(OH)2(3分)
本题解析:
试题分析:(1)由题干所给信息可知在pH=8.0~9.5时,Cr3+、Fe3+、Cu2+均转化为相应氢氧化物沉淀,因此利用流程可知滤渣的成分为Cr(OH)3、Fe(OH)3、Cu(OH)2。(2)在第③步中+3价Cr被氧化为+6价Cr,因此H2O2被还原,结合溶液为碱性和电荷守恒等可写出反应的离子方程式。(3)调节pH=13时,Cr(OH)3溶解,而Fe(OH)3、Cu(OH)2仍为固体,因此可通过过滤操作分离出[Cr(OH)4]-,过滤操作所需玻璃仪器有玻璃棒、烧杯、漏斗。(4)由电解图示知电解
本题难度:困难
2、选择题 如图所示,在一U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜色的次序是
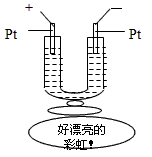 [???? ]
[???? ]
A.蓝、紫、红
B.红、蓝、紫
C.红、紫、蓝
D.紫、红、蓝
参考答案:C
本题解析:
本题难度:一般
3、填空题 右图为持续电解含一定CaCl2的溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入电解液中。
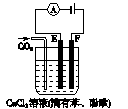 ????????????????
????????????????
(1)电解时,F极发生?????反应,电极反应式为???????,E极发生??????反应,电极反应式为????????????????,电解总反应式为???????????????????。
(2)电解池中产生的现象:
①??????????????????????????????????????????????;
②??????????????????????????????????????????????;
③??????????????????????????????????????????????。
参考答案:(1)氧化? 2Cl--2e- 本题解析:溶液中含有:Ca2+、H+、Cl-、OH-,通电时,Ca2+、H+移向阴极,由于H+放电能力比Ca2+强,在E极上发生反应:2H++2e-
本题解析:溶液中含有:Ca2+、H+、Cl-、OH-,通电时,Ca2+、H+移向阴极,由于H+放电能力比Ca2+强,在E极上发生反应:2H++2e- H2↑;Cl-、OH-移向阳极,Cl-在阳极放电;2Cl-+2e-
H2↑;Cl-、OH-移向阳极,Cl-在阳极放电;2Cl-+2e- 本题难度:简单
本题难度:简单
4、选择题 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图所示,下列说法正确的是
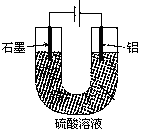
A.阳极电极方程式为: Al—3e—+6OH—=Al2O3+H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36L(标况)时,阳极增重2.4g
D.电解过程中H+移向Al电极
参考答案:C
本题解析:
试题分析:A、电解质为硫酸溶液,OH?不可能参加反应,错误;B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O  Al2O3+3H2↑,H2O减少,溶液的pH逐渐减小,错误;C、阴极反应为:2H++2e?=H2↑,H2的物质的量为3.36L÷22.4L/mol=0.15mol,则转移电子为:2
Al2O3+3H2↑,H2O减少,溶液的pH逐渐减小,错误;C、阴极反应为:2H++2e?=H2↑,H2的物质的量为3.36L÷22.4L/mol=0.15mol,则转移电子为:2
本题难度:一般
5、选择题 (2014届江西省景德镇市高三第一次模拟考试卷理综化学试卷)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:电池:Pb(s)+ PbO2(s)+2H2SO4(aq)= 2PbSO4(s)+ 2H2O(l)
电解池:2Al + 3H2O  Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
?
| 原电池
| 电解池
|
A
| H+移向Pb电极
| H+移向Pb电极
|
B
| 每消耗3molPb
| 生成2molAl2O3
|
C
| 正极:PbO2+4H++2e-=Pb2++2H2O
| 阳极:2Al+3H2O-6e-=Al2O3+6H+
|
D
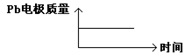
| 
| 
?
参考答案:D
本题解析:
A.根据同种电荷相互排斥,异种电荷相互吸引的原则,在原电池中,H+移向PbO2电极;在电解池H+移向Pb电极。错误。B.每消耗3molPb,电子转移6mol,由于在同一闭合回路中电子转移数目相等。所以在电解池中生成1molAl2O3.错误。C. 在原电池的正极发生反应PbO2+4H++2e-+SO42-=PbSO4+2H2O;在电解池阳极:2Al+3H2O-6e-=Al2O3+6H+。错误。D.在原电池中由于负极的变化为Pb→PbSO4.所以Pb电解质量增加。在电解池中,Pb作阴极,不参与氧化还原
本题难度:一般
|