微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲、乙两烧杯中各盛有100mL 3mol·L—1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲):V(乙)=1:2,则加入铝粉的质量为( )
A 5.4g B 3.6g C 2.7g D 1.6g
参考答案:A
本题解析:
试题分析:铝粉和盐酸反应方程式2Al+6HCl=2AlCl3+3H2,铝粉和NaOH反应方程式2Al+2NaOH+2H2O=2NaAlO2+3H2,根据方程式关系看到消耗等量的铝,需要盐酸的物质的量比NaOH多,但反应中V(甲):V(乙)=1:2,可知盐酸完全参与反应,根据H守恒,可知V(甲)=0.15mol,则V(乙)=0.3mol,对应方程式可知n(Al)=0.2mol,则加入铝粉的质量为5.4克,A正确。
考点:考查金属铝的性质、物质的量的计算
本题难度:一般
2、选择题 向100g浓度为18mol/L、密度为ρg/mL的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积????????
A.小于100mL
B.等于100mL
C.大于100mL
D.等于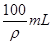
参考答案:A
本题解析:稀释前后溶质的质量不变,设加水的质量为x,
则100g×w1=(100g+x)×w2,
18mol·L-1的浓硫酸加到一定量的水中稀释成9mol·L-1的硫酸,
由c=1000ρw/M
及硫酸的浓度越大,密度越大,
则w1>w2,w1<2w2,
所以(100+x)/100<2,
解得x<100g,
又水的密度约为1g·mL-1,
则加水的体积小于100mL,
故选A.
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol O3所含有的原子数为3NA
B.18克H2O中,原子数为2NA
C.22.4 L氯化氢所含的原子数为2NA
D.NA个 CH4分子的质量为16g/mol
参考答案:A
本题解析:
试题分析:臭氧含义3个氧原子,A不正确;18克H2O的物质的量是1mol,其中原子数为3NA,B不正确;C中氯化氢的条件不一定是在标准状况下,物质的量不一定是1mol,C不正确;D中质量的单位是g,D不正确,答案选A。
考点:考查阿伏加德罗常数的有关计算和判断
点评:阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。要准确解答好这类题目,一是要掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系。
本题难度:一般
4、选择题 标准状况下V L氯化氢气体溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.ω = 36.5c/(1000ρ)
B.ρ = (36.5V+22400)/(22.4V+22.4)
C.ω =" 36.5V/(36.5V" +22400)
D.c = 1000Vρ/(36.5V+22400)
参考答案:B
本题解析:VL氯化氢的物质的量是V/22.4 mol,质量是36.5a/22.4 g,溶液的质量是(1000+36.5V/22.4)g,所以溶液的体积是(1000+36.5V/22.4)÷ρ ml。根据c=n/V可知,溶液的浓度是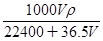 mol/L,因此选项B不正确,其余都是正确的,答案选B。
mol/L,因此选项B不正确,其余都是正确的,答案选B。
本题难度:一般
5、填空题 钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
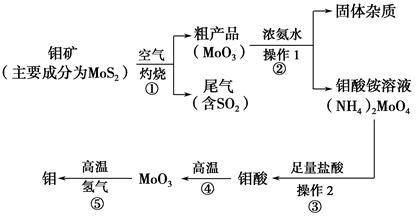
(1)写出反应①的化学方程式: 。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂 &# 160; 。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有 。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为 。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为 。
参考答案:(1)2MoS2+7O2 本题解析:(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫。
本题解析:(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫。
(2)二氧化硫可收集再利用,制备硫酸和盐类等。
(3)操作1和操作2都是分离固体与液体混合物,都是过滤操作。
(4)钼酸是二元酸,可直接写出钼酸钠。
(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:3CO+MoO3 Mo+3CO2,3H2+MoO3
Mo+3CO2,3H2+MoO3 Mo+3H2O,3 mol还原性气体理论上生成1 mol钼。n(CH4)=
Mo+3H2O,3 mol还原性气体理论上生成1 mol钼。n(CH4)= ×80%,n(H2+CO)=
×80%,n(H2+CO)=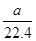 ×80%×90%×4 mol=
×80%×90%×4 mol=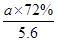 ,n(Mo)=
,n(Mo)=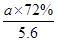 ×
×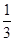 mol=
mol=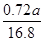 mol,m(Mo)=
mol,m(Mo)=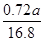 mol×96 g·mol-1≈4.11a g。
mol×96 g·mol-1≈4.11a g。
本题难度:一般