微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 “绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是
[???? ]
A.Cu → Cu(NO3)2
B.Cu → CuO →Cu(NO3)2
C.Cu → CuCl2 →Cu(NO3)2
D.Cu → CuSO4 →Cu(NO3)2
2、填空题 (12分)MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下:

已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、
MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是???? ▲???。
(2)除铁发生的离子反应方程式为???????? ▲?????????。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= ▲???mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解 的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是?????????▲???????????????????????????????
的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是?????????▲???????????????????????????????
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为?▲?时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH=?▲ ?时锰、铬去除率最好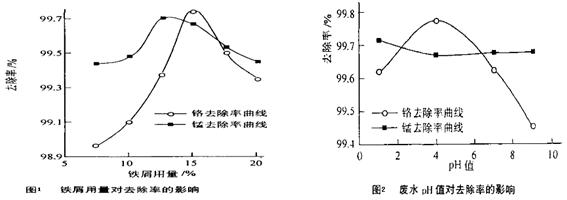
3、填空题 用离子交换法从海带中提取碘是一种较为先进的制碘工艺应用技术。
①浸泡海带:取海带500g,加13~15倍水量分两次浸泡,得浸出液6000mL左右,碘含量为0.5g/L。?
②碱化浸出液除褐藻糖胶:即海带浸出液1000mL,加入浓度为40% 的NaOH溶液,控制pH值为12左右,充分搅拌后使褐藻酸钠絮状沉淀而沉降。采用倾析法分离出清液。
③氧化游离:向上述清液中加入浓度为6mol× L-1的H2SO4溶液,使pH值为1.5~2。往酸化后溶液中加入NaClO溶液或H2O2溶液,充分搅拌并观察溶液颜色变化。待溶液由淡黄逐渐变成棕红色即表明I-离子已转变为多碘离子(I3-)。
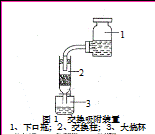
④交换吸附:氯型强碱性阴离子交换树脂(R—Cl表示)注入交换柱中(树脂层高度为12cm),如右图连接交换装置,待溶液全部通过后,树脂颜色变为黑红色。
⑤洗脱:分两步进行
第一步:取8~10% 的NaOH溶液40mL注入交换柱中。在强碱作用下,树脂颜色逐渐变浅,待树脂基本褪色后,放出溶液,收集于一小烧杯中为碱性洗脱液。????
第二步:取10% 的NaCl溶液40mL注入上述交换柱中。稍待一会儿,慢慢放出溶液收集于另一小烧瓶中,为氯化钠洗脱液。
⑥往碱性洗脱液中滴加H2SO4溶液(6mol/L),烧杯底部会析出一层泥状粗碘。
⑦往氯化钠洗脱液中滴加H2SO4溶液(6mol/L)使之酸化,再滴加10% 的NaNO2溶液(在通风橱中进行)。待溶液由无色转变为棕红色直至出现棕黑色浑浊。
⑧离心分离即得粗碘。
试回答下列问题
(1)步骤③在酸性条件下用NaClO(或H2O2)氧化碘的离子方程式:?? ? ?,
及I2 +I-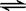 I3-。如何用化学方法检验有多碘离子生成?????????????????????。
I3-。如何用化学方法检验有多碘离子生成?????????????????????。
(2)第④步发生的离子反应为:????????????????????????????。
(3)步骤⑤洗脱时第一步发生的离子反应为(洗脱液中含有I-和IO3-离子):
???????????;第二步洗脱发生的离子反应为:?????????????????。
(4)步骤⑦发生反应的离子方程式为 ????????????????????????????????。
4、选择题 下列生产工艺不能体现“绿色化学”或环保思想的是 [???? ]
A.海水提镁:用电解氯化镁产生的氯气制取盐酸
B.工业制硫酸:提高尾气排放的烟囱高度
C.工业制胆矾:使用稀硫酸、双氧水溶解铜
D.火力发电:在燃煤中加入适量生石灰
5、实验题 (18分)硫酸是化学工业最重要的产品之一,工业制法如下。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管
Fe2O3+SO2+SO3↑+14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管 。
。

①试管b中得到的主要产物是???????????,检验该产物的方法是(结合离子方程式简要说明)??????????????????????????????????????????????????????????????????????。
②为检验反应的另一种生成物,试管c中应加入的试剂是????????????,简述相应的实验现象及结论??????????????????????????????????????????。
③所得硫酸的理论浓度(溶质的质量分数)为????????????????????????????????。
(2)目前,我国采用“接触法”制硫酸,生产设备如图所示:
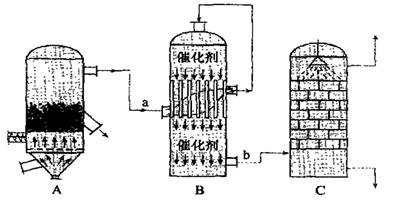
①图中设备A的名称是??????????????????????,a、b两处所含气体的化学式分别为???????????????????????????????、??????????????????????????????。
②有关接触法制硫酸的下列说法中,不正确的是???????????。
A.二氧化硫的接触氧化在合成塔中发生
B.吸收塔得到的硫酸浓度为98%
C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4%
D. B装置中反应的条件之一为较高温度是为了提高SO2的转化率
B装置中反应的条件之一为较高温度是为了提高SO2的转化率
(3)随着化学工业的发展,“接触法”全面替代了“绿矾热分解法”,请你从综合效益的角度指出“接触法”制硫酸的优势:①生产成本低、②原料易得、③????????????????、④??? ?????????????、⑤???????????????、⑥???????????????(可不填满)。
?????????????、⑤???????????????、⑥???????????????(可不填满)。