微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一块表面被氧化的钠质量是8.5g,投入到水中,完全反应得到标准状况下的H2?0.1g,则原钠块中被氧化的钠的质量是
A.2.3g
B.4.6g
C.6.2g
D.7.8g
参考答案:B
本题解析:
试题分析:由n(H2)=0.05mol计算出n(Na)=0.1mol,所以氧化钠为6.2g,其中钠元素质量为4.6g,此即为被氧化的钠的质量。
点评:常温下,钠被氧化生成氧化钠。
本题难度:一般
2、选择题 将含amolNa2CO3的溶液逐滴加入到含bmolHCl的溶液中与将含bmolHCl的溶液逐滴加入到含amol Na2CO3的溶液中,正确的描述是:
A.现象不同,产物种类及物质的量一定相等。
B.现象相同,产物种类及物质的量有可能相等。
C.现象不同,产物种类及物质的量不可能相等。
D.现象不同,产物种类及物质的量有可能相等。
参考答案:D
本题解析:碳酸钠和盐酸反应,分两步进行,反应式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑。若将含amol Na2CO3的溶液逐滴加入到含bmolHCl的溶液中,由于盐酸过量,所以会立即生成CO2气体。若将含bmolHCl的溶液逐滴加入到含amol Na2CO3的溶液中,一开始没有气体生成,只有当碳酸钠全部转化为碳酸氢钠时,再加入盐酸才能生成气体。由于a和b的关系未知,所以选项D是正确的,答案选D。
本题难度:一般
3、实验题 现有CaCO3和KHCO3的混合物,甲、乙两同学分别称取一定质量的该混合物来测定其中两种成分的质量比(已知K2CO3的分解温度远大于1000 ℃;气体体积均已折算成标准状况):
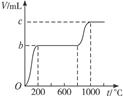
(1)甲同学取2.00 g混合物,并向其中加入过量的2.00 mol·L-1的盐酸,生成气体a mL。则a=____________(填数字),据此甲同学____________(填“能”或“不能”)计算出混合物两成分的质量比。若能,则m(CaCO3)∶m(KHCO3)=____________;若不能,此空不必作答。
(2)乙同学称取W g混合物充分加热,所得CO2气体的体积随温度变化的曲线如图所示,则m(CaCO3)∶m(KHCO3)=____________(请用含b、c的代数式表示)。
参考答案:(1)448?不能(2) 本题解析:(1)CaCO3+2HCl====CaCl2+H2O+CO2↑
本题解析:(1)CaCO3+2HCl====CaCl2+H2O+CO2↑
KHCO3+HCl====KCl+H2O+CO2↑
100 g??????????????????? 22.4 L
2.00 g???????????????????a
a=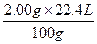 ="0.448" L="448" mL
="0.448" L="448" mL
因为
本题难度:简单
4、选择题 除去Na2CO3固体中少量NaHCO3的最佳方法是
A.加入适量盐酸
B.加热
C.加入NaOH溶液
D.配成溶液后通入CO2
参考答案:B
本题解析:
试题分析:A.若加适量盐酸,二者都能发生化学反应。错误。? B.加热NaHCO3分解:2NaHCO3 Na2CO3+ CO2↑+ H2O。最后得到的固体只含Na2CO3。正确。C.加入NaOH溶液,发生反应:NaOH+NaHCO3= Na2CO3+ H2O。但是由于反应无明显的实验现象,如果加入NaOH
Na2CO3+ CO2↑+ H2O。最后得到的固体只含Na2CO3。正确。C.加入NaOH溶液,发生反应:NaOH+NaHCO3= Na2CO3+ H2O。但是由于反应无明显的实验现象,如果加入NaOH
本题难度:一般
5、选择题 对碱金属元素,随着核电荷数的增大,下列说法中正确的是(??? )
A.原子半径依次增大,离子半径依次减小
B.单质的熔点、沸点依次降低
C.氧化物对应的水化物碱性依次增强
D.单质的还原性依次减弱
参考答案:BC
本题解析:本题考查碱金属元素的递变规律。
本题难度:简单