微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程:
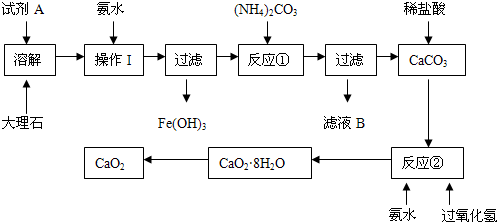
请回答下列问题:
(1)试剂A的名称是??????????????????;
(2)操作I的目的是?????????????????????????????????????;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有??????????????????????????????;
(4)写出反应②中生成CaO2·8H2O的化学方程式:??????????????????????????????????????????;
(5)制得的CaO2中一般含有CaO该化学兴趣小组通过实验测定制得的样品中CaO2的含量:称量0.6g样品于锥形瓶中,然后加入过量的浓度为2.00mol?L-1的盐酸20.00mL,再用浓度为2.00mol?L-1的氢氧化钠溶液滴定锥形瓶中的溶液,消耗氢氧化钠溶液11.00mL.该样品中CaO2的质量分数为????????。
参考答案:(1)硝酸或盐酸;?(2)调节溶液的pH,使Fe3+完全沉淀
本题解析:
试题分析:CaCO3能与稀HCl或稀硝酸发生反应,转化为可溶性物质,而硫酸与CaCO3反应产生的硫酸钙微溶于水,使反应不能继续进行。而Fe2O3能与酸反应得到可溶性的铁盐,因此试剂A是硝酸或盐酸;(2)向其中加入氨水的目的是调节溶液的pH,使Fe3+完全沉淀;然后过滤除去。(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有促进固体溶解的搅拌和为了分离难溶性固体与可溶性溶液的分离混合物的引流作用;(4)反应②中由CaCO3与H2O2?和氨水反应生成CaO2·8H2O的化学方程式是:CaC12?+ H2O2?+ 2NH3?+ 8H2O ═ CaO2·8H2O↓ + 2NH4Cl?;(5)n(HCl)= 2.00mol/L×0.02L=0.04mol。n(NaOH)=n(HCl)(过量)= 2.00mol/L×0.011L-0.022mol。因此样品产生的OH-的物质的量为0.018mol.。设样品中含有CaO2、CaO的物质的量分别x、y。则2x+2y=0.018mol;72x+56y=0.6g。解得x=0.006mol;y=0.003mol。所以该样品中CaO2的质量分数为[(0.006mol×72g/mol)÷0.6]×100%=72%。
本题难度:一般
2、选择题 有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,该试剂是(???)
A.盐酸
B.烧碱溶液
C.氨水
D.KSCN溶液
参考答案:B
本题解析:
试题分析:该题实际是五种溶液中的阳离子的鉴别。
A.盐酸和以上物质均不反应,A不符题意;????
B.加入烧碱溶液无明显现象的是NaCl;存在白色沉淀→灰绿色沉淀→红褐色沉淀的三色变化的是FeCl2;出现红褐色沉淀的是FeCl3;出现白色沉淀的是MgCl2;先出现白色沉淀,然后沉淀逐渐消失的是AlCl3。现象各不一样,B符合题意;???
C.氨水与MgCl2、AlCl3反应均生成白色沉淀,无法鉴别;?????
D.KSCN溶液只能鉴别FeCl3
点评:本题考查金属的重要化合物的知识,主要考查金属离子的性质,难度不大。
本题难度:一般
3、填空题 (14分) Mg(ClO3)2常用作催熟剂、除草剂等,下图为制备少量Mg(ClO3)2·6H2O的方法:
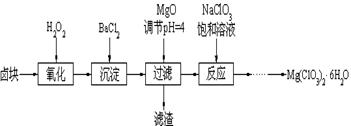
已知:1、卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质。
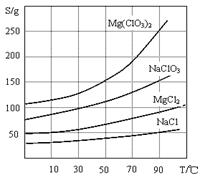
2、几种化合物的溶解度(S)随温度(T)变化曲线如上图。
(1)加入BaCl2的目的是除_________,如何判断该离子已除尽_____________________。
(2)加入NaClO3饱和溶液会发生反应:MgCl2+2NaClO3==Mg(ClO3)2+2NaCl↓,请利用该反应,结合溶解度图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应;②蒸发浓缩;③????????;④冷却结晶;
⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL配好的溶液于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/L K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
(3)写出步骤2中所发生反应的离子方程式??????????????????????????????????????。
(4)步骤3中若滴定前用标准液润洗滴定管,会导致最终结果?????(填“偏大”、“偏小”或“不变”)。
(5)产品中Mg(ClO3) 2·6H2O的质量分数为????????(计算结果保留两位小数) 。
参考答案:(14分)(1)?SO42-??(2分) ????
静
本题解析:
试题分析:(1)加入BaCl2的目的是除去SO42-,钡离子与硫酸根离子结合呈硫酸钡沉淀,过滤除去;检验SO42-是否除尽的方法是静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-已沉淀完全;
(2)Mg(ClO3)2的溶解度受温度变化影响大,温度高时溶解度较大,温度低时溶解度较小,所以需要趁热过滤除去氯化钠;
(3)步骤2中所发生反应是ClO3-与Fe2+在酸性条件下的氧化还原反应,生成氯离子和铁离子、水,离子方程式为6H++ClO3-+6Fe2+==6Fe3++Cl-+3H2O;
(4)滴定管在加入标准液前必须用标准液润洗,所以最终结果不变;
(5)根据消耗K2Cr2O7溶液15.00mL可计算未被ClO3-氧化的亚铁离子的物质的量是0.015L×0.1mol/L×6=0.009mol,则被ClO3-氧化的亚铁离子的物质的量是0.02L×1mol/L-0.009mol=0.011mol,则100mL溶液中ClO3-的物质的量是0.011mol×1/6×10=0.11/6mol,则样品中Mg(ClO3) 2·6H2O的质量为0.11/6mol/2×299g/mol=2.741g,所以产品中Mg(ClO3) 2·6H2O的质量分数为2.741g/3.5g×100%=78.31%.
本题难度:困难
4、简答题 91exam.org 氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等,为获得纯净的氧化铜并探究其性质,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
(1)制备氧化铜:
工业CuSO4
Ⅰ
?Ⅱ
CuSO4溶液Ⅲ?
CuSO4?5H2O…CuO
①步骤Ⅰ的目的是除去不溶性杂质.操作是______.
②步骤Ⅱ的目的是除去硫酸亚铁.操作是:滴加H2O2溶液,稍加热;Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.滴加H2O2的目的是______,加入Cu2(OH)2CO3粉末的目的是______.
③步骤Ⅲ的目的是得到CuSO4?5H2O晶体,操作是将CuSO4?5H2O溶液加热蒸发至有晶膜出现时,停止加热,______,水浴加热烘干.采用水浴加热的原因是______.
(2)探究氧化铜性质:
①取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3%H2O2溶液,只观察到A中有大量气泡,结论是______.
②为探究试管A中反应的速率,收集气体并测定其体积必需的实验仪器除导管、橡皮塞、水槽外还必须有______.
参考答案:(1)①不溶性杂质与溶液分离,利用过滤,则操作步骤为加适量水
本题解析:
本题难度:一般
5、选择题 除去下列括号内杂质的试剂或方法错误的是[???? ]
A.HNO3溶液(H2SO4),适量BaCl2溶液,过滤
B.CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气
C.KNO3晶体(NaCl),蒸馏水,结晶
D.C2H5OH(CH3COOH),加足量CaO,蒸馏(CH3COOH具酸的通性,C2H5OH易挥发)
参考答案:A
本题解析:
本题难度:一般
网站客服QQ: 960335752 - 14613519 - 791315772