微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列反应中,既属于离子反应又属于氧化还原反应的是(????)
A.BaCl2溶液和K2SO4溶液反应
B.点燃H2和O2的混合气体
C.NaOH溶液和CuSO4溶液反应
D.Zn放入盐酸中
参考答案:D
本题解析:反应中元素的化合价发生变化的是氧化还原反应,有离子参加反应的是离子反应, B只是氧化还原反应但不是离子反应;D二者都是;A、C只是离子反应,D正确。
本题难度:简单
2、填空题 (8分)稀HNO3和锌反应的化学方程式如下:
4Zn + 10 HNO3= 4Zn(NO3)2 +N2O↑+5H2O
(1)请标明上述化学方程式中电子转移的方向和数目。
(2)该反应中还原剂是 ,还原产物是 ,每2 mol Zn参加反应,转移的电子 个。
(3)上述反应中,HNO3没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸与总硝酸的物质的量之比是 。
参考答案:(8分)(1)  本题解析:考查氧化还原反应的有关判断和计算。
本题解析:考查氧化还原反应的有关判断和计算。
(1)根据反应的方程式可知,锌元素的化合价从0价升高到+2价,失去2个电子,作还原剂,而硝酸锌是氧化产物;硝酸中氮元素的化合价从+5价降低到+1价,得到4个电子,所以硝酸是氧化剂,N2O是还原产物,因此根据电子的得失守恒可知,表示为
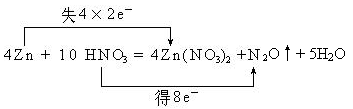 。
。
(2)根据反应的方程
本题难度:一般
3、选择题 P单质在反应4P+3KOH+3H2O===3KH2PO2+PH3中的变化是 [???? ]
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
参考答案:C
本题解析:
本题难度:简单
4、选择题 铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mlN2O4(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为(??)。
A.8.51g
B.8.26g
C.7.04g
D.9.02g
参考答案:A
本题解析:
试题分析:由题意可知,反应产生的气体折合成NO2一共是(4480mL·10-3+336ml10-3·2)/22.4L·mol-1=0.23mol,列出该反应的方程式,Cu+HNO3=Cu(NO3)2+2NO2↑+H2O, Mg+HNO3=" Mg" (NO3)2+2NO2↑+H2O,设合金中铜的物质的量为x,镁的物质的量为y,则可列出方程①64g/mol·x+24g/mol·y=4.6g;②2x+2y=0.23mol,联合①②即可解出x、y分别为0.046mol和0.069mol,再算出对应的沉淀
本题难度:简单
5、填空题 对于CO中毒、心肌梗塞、冠心病或小儿肺炎等危重患者都要采用吸氧治疗。普通医务室中没有氧气瓶,但一般都有消毒用的30%的过氧化氢溶液。同时还有可选用的试剂:KMnO4、HCl、H2SO4、MnO2、Mg粉、CuSO4、NaCl、葡萄糖。请写出一种能使过氧化氢中氧完全释放出来的反应方程式:_____________________________________________。
参考答案:2KMnO4+5H2O2+3H2SO4====K2SO4+2
本题解析:H2O2中O为-1价,变成O2释放出来,变成0价。虽然MnO2可催化H2O2分解,放出O2,但题中条件要求H2O2中的氧全部释放出来,故必须选择一个氧化剂。使用KMnO4强氧化剂可达到目的。
本题难度:简单