微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)合成氨反应原理为:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1 一种工业合成氨的简易流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1 一种工业合成氨的简易流程图如下:
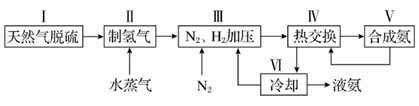
(1)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 ________。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.缩小容器的体积
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到2.2 mol CO、CO2和H2的混合气体,则CO转化率为________。
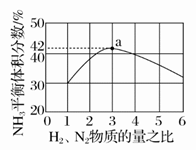
(2)图中表示500℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算H2的平衡体积分数:________。
(3)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述两点本流程中提高合成氨原料总转化率的方法:_______________________________________。
2、计算题 一氧化碳变换反应 CO(g)+ H2O(g)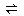 ?H2(g)+ CO2(g),在773K时,平衡常数Kc =" 9" ,如反应开始时CO和H2O的浓度都是0.020 mol/L ,计算在次条件下,CO的最大转化率是多少?
?H2(g)+ CO2(g),在773K时,平衡常数Kc =" 9" ,如反应开始时CO和H2O的浓度都是0.020 mol/L ,计算在次条件下,CO的最大转化率是多少?
3、选择题 升高温度,下列数据不一定增大的是??????????????????????????????
A.化学反应速率v
B.水的离子积常数Kw
C.化学平衡常数K
D.醋酸的电离平衡常数Ka
4、选择题 已知:N2(g)+3H2(g)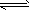 2NH3(g)△H=-QkJ/mol 现分别在相同条件下进行下述三个实验
2NH3(g)△H=-QkJ/mol 现分别在相同条件下进行下述三个实验

充分作用后,测得实验①反应放出热量为Q1kJ,实验②没有热量变化。则下列说法不正确的是 [???? ]
A.实验①反应放出热量值Q1=0.1Q
B.实验①达平衡时H2转化率为20%
C.实验③恒应吸收热量为Q1kJ
D.该条件下反应的平衡常数约为0.058 L2/mol2
5、简答题 在120℃时分别进行如下四个反应:
A.2H2S+O2═2H2O+2S???????????B.2H2S+3O2═2H2O+2SO2
C.C2H4+3O2═2H2O+2CO2????????D.C4H8+6O2═4H2O+4CO2
(1)若反应在容积固定的容器内进行,反应前后气体密度(d)和气体总压强(p)分别符合关系式d前=d后和?p前>p后的是______;符合关系式d前=d后和?p前=p后的是______(请填写反应的代号).
(2)若反应在压强恒定容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和?V前<V后的是______;符合d前>d后和?V前>V后的是______(请填写反应的代号).