微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 当密闭容器中反应mA(g)+nB(s)?pC(g)已经达到平衡后,将密闭容器的体积缩小,发现A的转化率也随之降低.那么,下列几个表示化学方程式化学计量数关系的式子中,普遍适用于上述一类反应的是( )
A.m+n>p
B.m+n<p
C.m>p
D.m<p
2、选择题 在一个容积固定不变的密闭容器中进行反应:2X(g)+Y(g)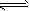 2Z(g)+W(s),已知将2molX和1 molY充入该容器中,反应在某温度下达到平衡时,Z的物质的量为p mol。下列说法中正确的是
2Z(g)+W(s),已知将2molX和1 molY充入该容器中,反应在某温度下达到平衡时,Z的物质的量为p mol。下列说法中正确的是
 [???? ]
[???? ]
A. 若把2 mol X和1molY充入该容器时,处于状态I,达到平衡时处于状态Ⅱ(如图甲所示),则该反应的正反应是吸热反应
B. 若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的密度未发生改变
C. 反应达到平衡后,再将2 molX和1mol Y充入该容器中,则反应速率v与时 间t的关系图如图乙所示
D. 若维持该题条件不变,仅从生成物开始配比,要求达到平衡时,Z的物质的量仍为pmol 则W的起始物质的量n(W)应满足的条件是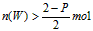
3、选择题 对于某一可逆反应,改变下列条件,一定能使化学平衡发生移动的是( )
A.增加某反应物的质量
B.使用催化剂
C.降低反应体系的压强
D.升高温度
4、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运?用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
____C?+?____K2Cr2O7?+?____→?____CO2↑+?____K2SO4?+?____Cr2(SO4)3?+?____H2O
请完成并配平上述化学方程式。
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+?2H2(g) CH3OH(g)??△H1=-116?kJ/mol
CH3OH(g)??△H1=-116?kJ/mol
①下列措施中有利于增大该反应的反应速率的是??_______;
A.随时将CH3OH与反应混合物分离???????
B.降低反应温度????
C.增大体系压强??????????????????????????
D.使用高效催化剂??
②已知:
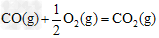 ?△H2=-283?kJ·mol-1???????
?△H2=-283?kJ·mol-1???????
 ?△H3=-242?kJ·mol-1
?△H3=-242?kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为______________;
③在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。
请回答:

ⅰ)在上述三种温度中,曲线Z对应的温度是___________________;
ⅱ)利用图中a点对应的数据,计算出曲线Z 在对应温度下CO(g)+?2H2(g)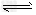 CH3OH(g)?的平衡常数K?=__________。
CH3OH(g)?的平衡常数K?=__________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为7×10-4mol/L?,则生成沉淀所需CaCl2溶液的最小浓度为__________。
5、填空题 二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题:
(1)煤的气化的主要化学反应方程式为:___________________________。
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。
(3)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)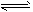 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)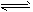 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)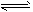 CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
CH3OCH3(g) + CO2(g)的ΔH= ___________;一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)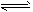 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下
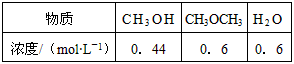
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率
v(CH3OH) = __________。