α 3
①.容器内压强P:2P甲与2P乙与P丙关系是?????????
②.变化的热量数值Q中, Q1与Q2的和是????????????
③.画出平衡时甲醇的百分含量(纵坐标)随温度(横坐标)的变化曲线,
要求画出压强不同的两条曲线(标出p1、p2,且p1<p2)。
④.在一定温度和压强下,CO和H2催化合成二甲醚反应为:
3H2(g)+3CO(g)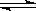 CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为???????????????????? CH3OCH3(g)+CO2(g)右图为绿色电源“直接二甲醚燃料电池”工作原理示意图,a电极的反应式为????????????????????
参考答案:① 2P甲等于2P乙且大于P丙?????????②Q1与Q2
本题解析:
(1)考查化学平衡中等效平衡知识。等温等容时反应前后气体体积变化的反应规律:将起始
投料量按化学计量系数之比换算成同一半边的物质,其物质的量与对应组分的起始投料量相
等,则建立的化学平衡是等效的,简称“等量等效”。这种情况下的等效平衡中的“等效”指
平衡体系中的各种性质( 各对应物的浓度、体积分数、转化率、物质的量) 是完全相同
的。类似于数学中的全等三角形,也可叫“全等平衡”。甲和乙容器内的平衡是完全相同的
平衡(等同平衡),各物理参数除热量都相同。由于体积不变,而1mol甲醇相当于是1molCO、
2moL H2,2mol甲醇相当于是2molCO、4moL H2,甲和乙中的平衡是等效的,则p甲=p乙;丙
相当于在乙的基础上增大压强,平衡向正反应方向进行,所以p丙<2p乙。
(2)甲和乙的反应是相反的,且平衡等效,所以Q1+Q2=90.8kJ。
(3)由于正反应是体积减小的、放热的可逆反应,所以升高温度,甲醇的含量降低。增大压强,甲醇的含量增大,所以图像是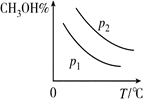 。 。
(4)原电池中负极失去电子,正极得到电子,所以而甲醚在负极通入,氧气在正极通入。根据装置图可判断,a处是负极,由于存在质子交换膜,所以负极电极反应式是 CH3OCH3 - 12e-+3H2O=2CO2+12H+。
本题难度:一般
2、选择题 已知某可逆反应mA(g)+ nB(g) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(???????) pC(g),在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是(???????)
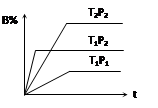
A.T1<T2、P1>P2、m+n>p,⊿H <0;
B.T1>T2、P1<P2、m+n>p,⊿H >0;
C.T1>T2、P1<P2、m+n<p,⊿H >0;
D.T1<T2、P1>P2、m+n<p,⊿H <0;
参考答案:C
本题解析:先看清横纵轴的意义:横轴表示时间,纵轴表示B的百分含量;
然后看线的走向:“T1P2、T2P2”线比较:在相同压强下,达平衡用时少的,温度高,即:T1 >T2;
“T1P1、T1P2”线比较:在相同温度下,达平衡用时少的,压强高,即:P2 >P1;
然后再看平行线部分:T1到T2(降温),B的百分含量增大,即平衡左移,说明逆向是放热的,则⊿H >0;
P1到P2(增压),B的百分含量增大,即平衡左移,说明逆向是气体体积减小的方向,则m+n<p;
本题难度:一般
3、选择题 一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是 2Z(g)达到平衡的标志是
A.正反应速率等于逆反应速率,且不等于零
B.X的浓度不再发生变化
C.Y的浓度不再发生变化
D.Z的浓度不再发生变化
参考答案:ABCD
本题解析:判断化学平衡的两个标志:正、逆反应速率相等,但不等于零(动态平衡),故A正确;
各组分浓度不变,故B、C、D正确;
本题难度:一般
4、计算题 (1)在一定温度下,向一个容积不变的容器中,通入2molN2和8molH2及固体催化剂,使之反应。已知:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程) 2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
①平衡时N2的物质的量????????, H2的转化率????????
②达到平衡时,放出的热量为????????????。
(2)在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应:2H2(g)+CO(g)  ?CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程) ?CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
①以H2的浓度变化表示的该反应的速率
②达平衡时CO的转化率
③该温度下的K
参考答案:(1)①1摩尔
②37.5%
③92.2kJ<
本题解析:
试题分析:解:(1)设反应掉的氮气的物质的量为x,即
N2(g)??? +3H2(g)??? ??????2NH3(g) ??????2NH3(g)
起始的物质的量(mol)? 2???????? 8?????????????????????? 0
转化的物质的量(mol)? x???????? 3x????????????????????? 2x
平衡的物质的量(mol)2-x??????? 8-3x???????????????????? 2x
根据PV=nRT,所以(10-2x)/10=80%,所以x为1mol,
所以平衡时N2的物质的量为2-1=1mol,
H2的转化率=3x/8=3*1/8*100%=37.5%
达到平衡时,放出的热量=1*92.2kJ=92.2kJ
(2)设反应掉的氢气的物质的量为x,即
2H2(g)?+?? CO(g) ??? ????CH3OH(g) ????CH3OH(g)
起始的物质的量(mol)???? 5??????????2????????????????????? 0
转化的物质的量(mol)???? x???????? 0.5x???????????????????? 0.5x
平衡的物质的量(mol)???5-x??????? 2-0.5x??????????????????? 0.5x
有因为CH3OH蒸气的浓度为2 mol/L,所以0.5x=2×0.5,所以x=2mol,
所以以H2的浓度变化表示的反应速率v(H2)="2/0.5/5=0.8" mol/(L·min),
达平衡时CO的转化率=1/2×100%=50%,
K=c(CH3OH)/c2(H2)c(CO)=2/(6*6*2)=0.028。
点评:本题综合考查了化学反应,平衡常数的相关计算,有一定的综合性,考查的知识点比较全面,是一道不错的计算题
本题难度:一般
5、选择题 一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)  ?Y(g)+Z(s),以下能说明反应达到平衡标志的是 ?Y(g)+Z(s),以下能说明反应达到平衡标志的是
A.混合气体的压强不再变化
B.X、Y、Z的物质的量之比为2:1:1
C.单位时间内生成lmolY的同时分解2mol X
D.X的分解速率与Y的消耗速率相等
参考答案:A
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系所以B不正确。根据方程式可知,反应前后体积是变化的,所以压强也是变化的,因此A正确。C中反应速率的方向相同,不能说明。D中反应速率的方向相反,但不满足反应速率之比是相应但化学计量数之比,不正确。答案选A。
本题难度:简单
|