微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于?????????????????????。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
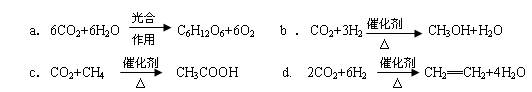
以上反应中,最节能的是???????????,原子利用率最高的是???????????。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
 ??????? CO2(g)+3H2(g)?????? CH3OH(g)+H2O(g)△H=-49.0kJ/mol
??????? CO2(g)+3H2(g)?????? CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
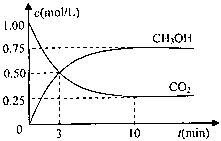
①从反应开始到平衡,氢气的平均反应速率v(H2)=?????mol/(L·min)
②该反应的平衡常数表达式为????????????????,升高温度,平衡常数的数值将
????????????(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是????????.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:

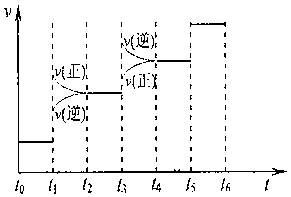
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
 ??????
??????
图t1时引起平衡移动的条件可能是??????????????。
其中表示平衡混合物中NH3含量最高的一段时间是???????????????。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为?????????。
参考答案:(12分)(1)保护臭氧层
(2)a? c
(3
本题解析:略
本题难度:简单
2、选择题 在某一化学反应,0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为[???? ]
A.3mol/L
B.0.3mol/L·s
C.0.6mol/L·s
D.0.1mol/L·s
参考答案:C
本题解析:
本题难度:简单
3、选择题 已知可逆反应: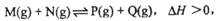 在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,
在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1, c(N)="2.4" mol·L-1;达到平衡后,M的转化率为60%,若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,
c(N)=" a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a为?????????????????(????)
A.5
B.6
C.7
D.8
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列表格中的各种情况,可以用如图所示曲线表示的是
选项
| 反应
| 纵坐标
| 甲
| 乙
|
A
| 相同质量的氨气,在同一容器中发生反应:2NH3 N2+3H2 N2+3H2
| 氨气的转化率
| 500 ℃
| 400 ℃
|
B
| 等质量的钾、钠分别与足量的水反应
| H2的质量
| 钠
| 钾
|
C
| 在体积可变的恒压容器中,体积之比为1∶3的N2、H2:N2+3H2 2NH3 2NH3
| 氨气的浓度
| 活性高的催化剂
| 活性一般的催化剂
|
D
| 2 mol SO2和1 mol O2在相同温度下发生反应:2SO2+O2 2SO3 2SO3
| SO3的物质的量
| 2个大气压
| 10个大气压
?
参考答案:B
本题解析:温度升高,反应速率加快,达到平衡的时间较短,A项不符合;钾比钠活泼,反应结束的时间较短,等质量的钠、钾与足量水反应产生H2的质量:钠大于钾,B项符合;使用催化剂不能使平衡移动,C项不符合;压强增大,平衡正向移动,SO3的物质的量增大,D项不符合。
本题难度:一般
5、填空题 (12分)现在普遍应用的工业合成氨的方法是哈伯于1905年发明的,但此法反应物的转化率不高。
(1)已知1 mol N2(g)与适量H2(g)完全反应,当生成NH3(g)0.1mol时,放出9.22kJ热量,写出反应的热化学方程式:???????????????????????????????????????。
(2)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1?????K2(填“>”? “="”" 或 “<” )。
(3)在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为??????????,用氮气表示的反应速率:??????????????????。若想提高氨气的产率,根据化学平衡移动原理,请提出合理的建议:?????????????????????(任意写一条)。
(4)在上述相同条件下,若起始时加入4 mol NH3、2 mol H2及固体催化剂,反应达到平衡时NH3的体积分数比(3)中??????????(填“大”、“小”或“相等”)。
(5)随着对合成氨研究的发展,2001年两位希腊化学家提出了电解合成氨的方法,即在常压下把氢气和用氦气稀释的氮气,分别通入一个加热到570℃的电解池中,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如右图)。在电解法合成氨的电解池中???????????????(填“能”或“不能”) 用水作电解质溶液的溶剂,原因是??????????????。
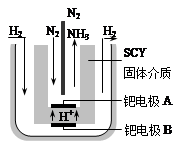
钯电极A是电解池的?????极(填“阳”或“阴”),该极上的电极反应式是????????????????。
参考答案:(1)N2(g)+3H2(g) 本题解析:(1)在热化学方程式中,物质的系数表示参加该反应的各物质的物质的量:生成NH3(g)0.1mol时,放出9.22kJ热量,则生成NH3(g)2mol时,放出9.22kJ×20="184.4" kJ热量,故正确的热化学方程式为:N2(g)+3H2(g) 本题解析:(1)在热化学方程式中,物质的系数表示参加该反应的各物质的物质的量:生成NH3(g)0.1mol时,放出9.22kJ热量,则生成NH3(g)2mol时,放出9.22kJ×20="184.4" kJ热量,故正确的热化学方程式为:N2(g)+3H2(g) ?2NH3(g)??△H =-184.4 kJ·mol-1; ?2NH3(g)??△H =-184.4 kJ·mol-1;
(2)由(1)得:△H<0,正向为放热反应,升温平衡逆向移动,则K1>K2;
(3) N2(g)+3H2(g) ?2NH3(g) ?2NH3(g)
n0??? 2mol? 8mol??????? 0
△n??? x???? 3x???????? 2x
n(平衡) 2-x? 8-3x??????? 2x
由PV=nRT,得:在恒温、恒容条件下,P1/P2=n1/n2,
即P1/(80%×P1)=(2mol+8mol)/[(2-x)+(8-3x)+2x],求解,得:x="1" mol;
氨气的体积分数=2x/[(2-x)+(8-3x)+2x]= 25%;
用氮气表示的反应速率=(2x/10)mol·L-1÷10 min=0.01mol/(L·min);
若想提高氨气的产率,即使平衡正向移动;
(4)N2(g)+3H2(g) ?2NH3(g) ?2NH3(g)
n0’ 0??? 2mol?????? 4mol
与(3)的初始态相当,则(3)、(4)为“等效平衡”关系,故反应达到平衡时NH3的体积分数比(3)中相等;
(5)有图,得:向A极通入氮气,反应后生成氨气,则N由0价降低为-3价,也就是说N发生了得电子的还原反应,而发生还原反应的电极定义为阴极
本题难度:一般
|