pH<7
请回答:
(1)从①组情况分析, HA是强酸还是弱酸???????????????????????。
(2)②组情况表明,c??????0.2 (选填“大于”、“小于”或 “等于”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是?????????????????。
(3)从③组实验结果分析,说明HX的电离程度______NaX的水解程度(选填“大于”、“小于”或 “等于”),该混合溶液中离子浓度由大到小的顺序是???????????????。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=??????????????mol·L-1。写出该混合溶液中下列算式的精确结果(不能作近似计算)。
c(Na+)-c(A-)=?????????????mol·L-1???;c(OH-)-c(HA)=?????????????mol·L-1
参考答案:(1)??? HA是弱酸;(1分)?????(2)?大于;(
本题解析:(1)一元酸HA和NaOH溶液等体积等浓度混合,溶液显碱性,所以反应后水解显碱性,因此酸是弱酸。
(2)由于恰好反应,溶液显碱性,所以要使溶液显中性,则酸必须过量,即c大于0.2mol/L。根据电荷守恒c(OH-)+c(A-)=c(Na+)+c(H+)可知,c(A-)=c(Na+)。
(3)在③中酸过量,且剩余的酸和生成的NaX的浓度是相同的。由于溶液显酸性,说明酸的电离程度大于盐的水解程度,所以此时溶液中离子
本题难度:一般
2、选择题 物质的量浓度相同的下列溶液,pH由大到小排列正确的是
A.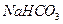 、 、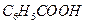 、 、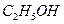 、 、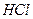
B.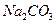 、 、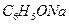 、 、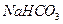 、 、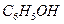
C.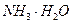 、 、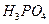 、 、 、 、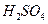
D.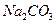 、 、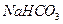 、 、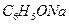 、 、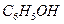
参考答案:B
本题解析:略
本题难度:简单
3、选择题 下列混合溶液中,各离子浓度的大小顺序正确的是???????(???)
A.10 mL 0.1 mol·L-1氨水与10 mL 0.1 mol·L-1盐酸混合,
c(Cl-)>c(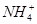 )>c(OH-)>c(H+) )>c(OH-)>c(H+)
B.10 mL 0.1 mol·L-1NH4Cl溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.10 mL 0.1 mol·L-1CH3COOH溶液与5 mL 0.2 mol·L-1NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D.10 mL 0.5 mol·L-1NaOH溶液与6 mL 1 mol·L-1盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
参考答案:B
本题解析:A、恰好中和生成NH4Cl,水解呈酸性,故有c(H+)>c(OH-);
B、恰好反应生成NH3·H2O,只考虑其电离呈碱性;
C、恰好反应生成CH3COONa,CH3COO-水解呈碱性,故Na+)>c(CH3COO-);
D、中和后,盐酸过量,c(H+)>c(OH-);
本题难度:一般
4、选择题 0.1 mol / L Na2CO3和0.1 mol / L NaHCO3溶液的pH值比较(????)
A.大于
B.等于
C.小于
D.不能肯定
参考答案:A
本题解析:
试题分析:Na2CO3溶液中CO32?水解,NaHCO3溶液中HCO3?水解,CO32?的水解程度大于HCO3?的水解,所以0.1 mol / L Na2CO3溶液的pH大,故A项正确。
本题难度:一般
5、选择题 常温下,等物质的量浓度的三种盐溶液NaX、NaY、NaZ,其溶液的pH依次为7、8、9,下列有关说法正确的是(?? )
A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>HY>HX
B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
C.X-、Y-、Z-三种酸根均能水解,且水解程度Z->Y->X-
D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(Z-)>c(Y-)>c(X-)
参考答案:B
本题解析:
试题分析:A.因pH越大,说明酸根离子水解越是强烈,对应的酸越弱.所以HX、HY、HZ的酸性由强到弱的顺序:HX>HY>HZ,错误;B.盐NaX的pH=7,所以是强酸强碱盐,NaY、NaZ溶液的pH>7,是弱酸强碱盐,HX、HY、HZ的酸性由强到弱的顺序:HX>HY>HZ,正确;C.盐NaX的pH=7,不会水解,酸根离子水解越是强烈,对应的酸越弱,溶液的碱性越强,所以水解程度Z->Y-,错误;D.三种盐溶液中X-、Y-、Z-的浓度大小顺序c(X-)>c(Y-)>c(Z-),错误.
本题难度:一般
|