微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
 已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
已知:①Fe3+、Al3+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2和12.4;Al(OH)3完全溶解的pH为11.8。②常温下,饱和氨水的pH约为11。
请回答:(1)写出A与氢氧化钠溶液反应的化学方程式:????????????????????????????????。
(2)上述流程中试剂②应该是???????????(填以下字母编号)。
A.氢氧化钠
B.氧化铝
C.氨水
D.水
(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是
????????????????????????????????????????????????????????????????????。
(4)计算溶液F中c(Mg2+)=?????????????( 25℃时,氢氧化镁的Ksp=5.6×10-12)。
(5)工业生产中将固体C灼烧后的产物与KNO3、KOH固体加热共熔制备净水剂K2FeO4,同时获得一种亚硝酸盐,请写出制得K2FeO4的化学方程式:????????????????????????????????????。
参考答案:(共10分,每空2分)
(1)SiO2+2NaOH=N
本题解析:
试题分析:(1)混合物中和盐酸不反应的是二氧化硅,即固体A是二氧化硅。二氧化硅是酸性氧化物,则二氧化硅和氢氧化钠溶液反应的化学方程式是SiO2+2NaOH=Na2SiO3+H2O。
(2)溶液B中含有铁离子、铝离子和镁离子,所以根据氢氧化物沉淀时的pH可知,如果控制pH=3.7,析出的沉淀是氢氧化铁,即固体C是氢氧化铁。溶液B中含有铝离子和镁离子,则氢氧化物沉淀时的pH和氢氧化铝溶解时的pH可知,E时氢氧化镁,F是偏铝酸盐,所以试剂②是氢氧化钠,答案选A。
(3)如果pH过小,则会导致镁离子沉淀不完全及氢氧化铝溶解不完全,所以应该可知pH=13。
(4)由于溶液中OH-的浓度是0.1mol/L,所以根据氢氧化镁的溶度积常数可知,溶液中镁离子的浓度是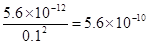 。
。
(5)氢氧化铁分解生成氧化铁,所以根据原子守恒可知,制备高铁酸钾的化学方程式是Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
点评:该题是高考中的常见题型,试题难度较大,对学生的要求高。本题关键是明确反应的原理,理解所给的信息,然后灵活运用即可。该题有利于学生的逻辑思维能力和灵活应变能力,有利于提高学生分析问题、解决问题的能力。该题综合性强,学生不易得分。
本题难度:一般
2、选择题 下列各组混合物不能用分液漏斗分离的是[???? ]
A.硝基苯和水
B.苯和甲苯
C.溴苯和NaOH溶液
D.甘油和水
参考答案:BD
本题解析:
本题难度:简单
3、选择题 为提纯下列物质(括号中为杂质),所选除杂试剂和分离的主要操作方法都合理的是
选项
| 被提纯的物质(杂质)
| 除杂试剂
| 主要操作方法
|
A
| NaHCO3溶液(Na2CO3)
| 澄清石灰水
| 过滤
|
B
| NaCl溶液(Br2)
| 乙醇
| 分液
|
C
| CO2(SO2)
| 饱和NaHCO3溶液
| 洗气
|
D
| KNO3溶液(KOH)
| FeCl3溶液
| 过滤
?
参考答案:C
本题解析:
试题分析:A、澄清石灰水与NaHCO3溶液和Na2CO3溶液都反应,错误;B、乙醇与NaCl溶液和Br2都能溶解,错误;C、饱和NaHCO3溶液能与二氧化硫反应生成二氧化碳,并且二氧化碳在碳酸氢钠中的溶解度很小,正确;D、引进了新的杂质氯离子,错误。
本题难度:一般
4、选择题 检验下列物质中是否含有杂质(括号内为杂质),检验方法及除杂试剂均正确的是(?? )
物质及其杂质
| 检验
| 除杂
| A.Cl2(HCl)
| 湿润的淀粉KI试纸
| 饱和食盐水
| B.NaHCO3溶液(Na2CO3)
| ?Ca(OH)2溶液
| 过量CO2
| C.CO2(HCl)
| AgNO3溶液(含稀硝酸)
| 饱和Na2CO3溶液
| D.NO(NO2)
| 观察颜色或湿润的淀粉KI试纸
| 水
?
参考答案:D
本题解析:湿润的淀粉KI试纸只能检验氯气,不能检验氯化氢气体,A错误;Ca(OH)2溶液与NaHCO3溶液或Na2CO3溶液都能产生沉淀,无法检验,B错误;选项C检验方法正确,除杂方法不对,CO2能与饱和Na2CO3溶液反应;D选项检验及除杂方法都正确,不引入新的杂质。
本题难度:一般
5、选择题 在实验室中,下列除去杂质的方法不正确的是( )
A.溴苯中混有溴,加入碳酸钠溶液,振荡,然后分液
B.乙烷中混有乙烯,通入氢气,在一定条件下反应,使乙烯转化为乙烷
C.硝基苯中混有浓HNO3和浓H2SO4,将其倒入NaOH溶液中,静置,分液
D.乙烯中混有SO2和CO2,将其通入NaOH溶液中洗气
参考答案:B
本题解析:溴能与碳酸钠溶液反应,而溴苯不能与之反应,故A正确;乙烷中的乙烯,若通过和H2发生加成反应除去时,因氢气的量不好控制,则得到的乙烷中可能混有过量的H2,故B错;浓HNO3、浓H2SO4均与NaOH溶液反应,故C正确;SO2和CO2都属于酸性氧化物,均能与碱液反应,故D正确。
本题难度:一般
|
|