微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,下列溶液中的微粒浓度关系正确的是
常温下甲、乙两醋酸溶液,测得甲的pH= a,乙的pH= a+1
下列推断中正确的是(??)
A.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍
B.物质的量浓度c(甲)=10c(乙)
C.中和等物质的量的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
参考答案:AC
本题解析:甲的pH= a,乙的pH= a+1,则溶液中氢离子浓度分别是10-amol/L和10-a-1mol/L,则由水电离出的氢离子浓度分别是10a-14mol/L和10a-13mol/L,所以选项A正确,D不正确;由于醋酸是弱酸,存在电离平衡,稀释促进电离,所以物质的量浓度c(甲)>10c(乙),B不正确,因此选项C正确,答案选AC。
本题难度:一般
2、选择题 在下列各溶液中,离子一定能大量共存的是[???? ]
A.强酸溶液中:K+、Fe2+、MnO4-、SO42-
B.含有0.1mol·L-1HCO3-的溶液中:K+、Ca2+、OH-、NO3-
C.含有0.1mol·L-1Cu2+的溶液中:Na+、K+、S2-、SO42-
D.室温下,pH=14的溶液中:Na+、K+、NO3-、CO32-
参考答案:D
本题解析:
本题难度:一般
3、选择题 室温下,在pH=12的某碱溶液中,由水电离的c(OH-)为(??? )
A.1.0×10-7 mol·L-1
B.1.0×10-6 mol·L-1
C.1.0×10-2 mol·L-1
D.1.0×10-12 mol·L-1
参考答案:D
本题解析:由于是碱溶液,pH=12也即水电离出的c(H+)=1×10-12 mol·L-1。水电离的c(H+)=c(OH-),故由水电离出的c(OH-)也为1×10-12 mol·L-1。
本题难度:简单
4、填空题 某无色溶液X,由Na+、Ag+、Ba2+、Al3+、AlO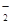 、MnO
、MnO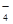 、CO
、CO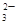 、SO
、SO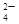 中的若干种离子组成,取溶液进行右图实验:
中的若干种离子组成,取溶液进行右图实验:
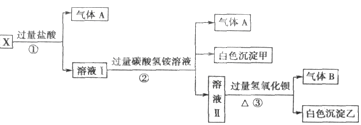
(1)白色沉淀甲是 。
(2)X溶液中一定存在的离子是 。
(3)白色沉淀乙中一定有: ,可能有 。
(4)若将过量的气体A与适量的气体B通入水中,写出反应的化学方程式 。
参考答案:
(1)Al(OH)3
(2)Na+、Al3+、
本题解析:
试题分析:MnO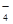 为紫红色,不符合题意;加入过量盐酸有气体产生确定有CO
为紫红色,不符合题意;加入过量盐酸有气体产生确定有CO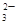 ,Ag+、Ba2+、Al3+与其不共存,溶液中不能存在;阳离子只有Na+,一定存在;加入碳酸氢铵,产生的气体是其与过量的盐酸反应生成的CO2,沉淀为氢氧化铝,即溶液中含有AlO
,Ag+、Ba2+、Al3+与其不共存,溶液中不能存在;阳离子只有Na+,一定存在;加入碳酸氢铵,产生的气体是其与过量的盐酸反应生成的CO2,沉淀为氢氧化铝,即溶液中含有AlO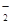 ,溶于过量的盐酸形成Al3+,进而与碳酸氢铵双水解,产生沉淀和气体;加入氢氧化钡气体为氨气,沉淀为BaSO4或过量的碳酸氢铵与氢氧化钡反应生成的BaCO3,所以溶液一定含有Na+、Al3+、CO
,溶于过量的盐酸形成Al3+,进而与碳酸氢铵双水解,产生沉淀和气体;加入氢氧化钡气体为氨气,沉淀为BaSO4或过量的碳酸氢铵与氢氧化钡反应生成的BaCO3,所以溶液一定含有Na+、Al3+、CO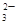 ,不能确定有SO
,不能确定有SO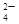 。
。
考点:考查离子共存与离子检验有关问题。
本题难度:困难
5、填空题 (8分)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液加热后,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
试回答下列问题
(1)由实验②可知溶液中含有的离子为???????????????,在100mL溶液中该离子的物质的量浓度为????????????????????
(2)由实验③可以判断中溶液中含有的离子为?????????????
(3)由上述实验信息判断下列说法中正确的是???????????
A.K+一定存在
B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在
D.Ba2+一定不存在,Mg2+可能存在
参考答案:(1) NH4+???? 0.4 mol/L?????(2)
本题解析:根据①可知溶液中含有氯离子或CO32-或SO42-。由②可知溶液中含有0.04mol NH4+。根据③可知白色沉淀是硫酸钡和碳酸钡的混合物,其中硫酸钡是2.33g,物质的量是2.33g÷233g/mol=0.01mol。碳酸钡是6.27g-2.33g=3.94g,物质的量是3.94g÷197g/mol=0.02mol。有CO32-,则一定没有Mg2+和Ba2+。根据溶液的电中性可知,溶液中必须含有钾离子,而氯离子无法排除。
本题难度:一般