微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量关系可表示为( )
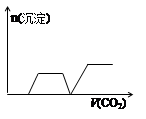
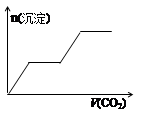
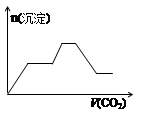
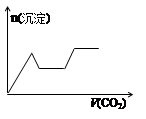
A B C D
参考答案:C
本题解析:
试题分析:将二氧化碳气体通入含有氢氧化钾,氢氧化钡,KAlO2的混合溶液中,生成沉淀的量和通入二氧化碳的量的关系以二氧化碳的体积为横坐标,以沉淀的物质的量为纵坐标的图象的画法,可以做如下分析:CO2先与Ba(OH)2反应(有沉淀BaCO3生成),当Ba(OH)2消耗完毕后再与KOH反应(此时无沉淀);最后与KAlO2反应(有沉淀Al(OH)3生成),以上过程中图形应是:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成];过量的CO2还可以继续与K2CO3反应得到KHCO3,继续过量的CO2还可以使BaCO3沉淀溶解,最后是Al(OH)3沉淀,所以接着的图形应该为:平台,沉淀(BaCO3)减少,平台,故整个过程的图形应为:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成],平台,沉淀(BaCO3)减少,平台,满足以上关系的图象为C,故选:C。
考点:考查二氧化碳通入混合溶液中的反应顺序
本题难度:一般
2、选择题 下列各组物质之间的反应,调节反应物用量,离子方程式不变的是 ( )
A.稀硝酸和Fe
B.NaAlO2溶液和盐酸
C.AlCl3溶液和氨水
D.CO2通入NaOH溶液
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列反应的离子方程式正确的是
A.氧化铜跟硝酸反应 Cu2++O2-+2H+=Cu+H2O
B.碳酸镁跟硝酸反应 CO32-+2H+=CO2↑+H2O
C.铜跟稀硝酸反应 Cu+4H++NO3-=Cu2++NO↑+2H2O
D.铁跟浓硝酸共热 Fe+6H++3NO3-=Fe3++3NO2↑+3H2O
参考答案:D
本题解析:
试题分析:A、CuO+2H+=Cu2++H2O;B、MgCO3+2H+=Mg2++CO2↑+H2O;C、3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;D正确;答案选D。
考点:考查离子方程式正误判断。
本题难度:一般
4、填空题 将FeCl3溶液与NH4SCN溶液混合发生如下反应
①Fe3++SCN- Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN-
Fe(SCN)2+ K1="200" ②Fe(SCN)2++SCN- Fe(SCN)2+ K2
Fe(SCN)2+ K2
红色 深红色
(1)已知:若起始c(Fe3+)、c(SCN-)均为0.001 mol/L,测得混合溶液中c(Fe3+)约为8.5×10-4 mol/L,c[Fe(SCN)2+]约为1.5×10-4 mol/L,c[Fe(SCN)2+]约为5×10-6 mol/L,则反应②的平衡常数K2为 。
(2)取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,溶液颜色均加深,其原因是 。仔细观察,滴加NH4SCN溶液时,混合液颜色更深一些,其原因是 。
(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,写出H2O2与Fe2+反应的离子方程式 ,继续滴加H2O2,溶液褪色,产生大量能够使澄清石灰水变浑浊的气体且硫氰根中氮元素全部转化为N2,向反应后的溶液中滴加BaCl2溶液,有不溶于稀盐酸白色沉淀生成。写出H2O2与SCN-反应的离子方程式 。
(4)为测定某溶液中c(Cl-),取待测液V1 mL,向其中加入V2 mL浓度为c2 mol/L的AgNO3溶液(过量),再加入少量铁铵矾[NH4Fe(SO4)2·12H2O]作指示剂,用NH4SCN标准溶液(浓度为c3 mol/L)滴定剩余的Ag+,消耗NH4SCN溶液体积为V3 mL。(已知Ag++SCN- = AgSCN↓(白色沉淀),Ksp(AgSCN)=4.9×10-13、Ksp(Ag Cl)=1.56×10-10)。请回答:
①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤,则测定结果将 。(填“偏高”,“偏低”或不变)。
②最终测得c(Cl-)= mol/L。
参考答案:(1)39.7
(2)两种物质均促使①②反应向正向移动
本题解析:
试题分析:(1)反应②的平衡常数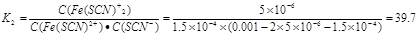
(2) 取两份混合溶液,分别向溶液中滴加同体积同浓度的FeCl3溶液与NH4SCN溶液,由于Fe3+、SCN-的浓度都增大,使①②两个可逆反应都向正向移动,产生更多的有色物质,实验溶液颜色均加深。(3)向FeCl2与NH4SCN混合溶液中滴加酸化的H2O2溶液,溶液先变红,是因为发生反应:H2O2+2H++2Fe2+= 2Fe3++ 2H2O,然后发生上述的①②反应。当继续滴加H2O2,溶液褪色是因为又发生了反应2SCN-+11H2O2= 2SO42-+2CO2↑+N2↑+ 10H2O+2H+ ,由于消耗了SCN-,使两个可逆反应的化学平衡都向逆反应方向移动,所以溶液的元素变浅甚至褪去。(4)①在用NH4SCN标准溶液滴定前,应先通过过滤除去生成的AgCl,若不过滤除去生成的AgCl,在进行滴定时当溶液中Ag+降低到一定浓度时,AgCl沉淀就会逐渐溶解转化为溶液中,而与滴加的SCN-发生沉淀反应Ag++SCN- = AgSCN↓,这样原待测溶液中Cl-消耗的Ag+就会偏少。所以测定结果将偏低。②n(SCN-)=C·V=C3·V3×10-3mol,根据Ksp(AgSCN)=4.9×10-13可得剩余的Ag+的物质的量n(Ag+)=n(SCN-) =C3·V3×10-3mol,则与Cl-的Ag+的物质的量为:(C2·V2×10-3- C3·V3×10-3)mol因为Ag++Cl-=AgCl↓所以原来的溶液中含有的氯离子的物质的量为(C2·V2×10-3- C3·V3×10-3)mol。因此最终测得c(Cl-)=n(Cl-)/V=(C2·V2×10-3- C3·V3×10-3)mol÷V3×10-3L=(C2·V2- C3·V3)÷V3mol/L.
考点:考查外界条件对化学平衡移动的影响、离子方程式的书写及化学平衡常数、溶液中离子的浓度的计算等知识。
本题难度:困难
5、选择题 下列反应的离子方程式正确的是( )
A.Fe与稀H2SO4反应:2Fe + 6H+ ="=" 2Fe3+ + 3H2↑
B.硫酸铜溶液与氢氧化钡溶液反应:Ba2++ SO42
参考答案:
本题解析:
本题难度:困难