微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列图示与对应的叙述不相符的是(???)

A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C.图3表示压强对可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)的影响,乙的压强比甲的压强大
CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D.图4表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
参考答案:B
本题解析:A.pH=10的氢氧化钠溶液和氨水,稀释时一水合氨继续电离,则稀释时NaOH的pH变化大,所以a表示氨水稀释时pH的变化曲线,A正确;B.先发生NaOH与盐酸的反应不生成沉淀,然后发生NaAlO2+HCl+H2O=Al(OH)3↓+NaCl、Al(OH)3 +3HCl=AlCl3+3H2O,沉淀生成与溶解消耗酸为1:3,与图象不符,B错误;C.可逆反应CO(g)+H2O(g) 本题难度:一般
本题难度:一般
2、填空题 现有如下两个反应:(A)NaOH + HCl = NaCl + H2O (B)2FeCl3 + Cu = 2FeCl2 + CuCl2
(1)根据两反应本质,判断能否设计成原电池(填“能”或“不能”)
(A)_______________(B)_______________
(2)如果(A或B)不能,说明其原因__________________________
(3)如果(A或B)可以,则写出正、负极材料及其电极反应式,电解质溶液
负极:____________; 正极:____________; 电解质溶液:______________
参考答案:(1)(A)不能;(B)能
(2)(A)的反应是非氧
本题解析:
本题难度:一般
3、选择题 用石墨电极电解CuCl2溶液(见右图)。下列分析正确的是
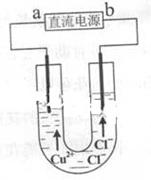
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察到黄绿色气体
参考答案:A
本题解析:与电源的正极的电极为阳极,带正电,溶液中阴离子向阳极移动,根据图示可知,b为电源的正极,a为电源的负极,A正确;CuCl2溶于水就发生电离,不需要通电,B不正确;阴离子Cl-在阳极上发生氧化反应2Cl--2e-=Cl2,C不正确;阴离子Cl-在阳极上发生氧化反应2Cl--2e-=Cl2,通电一段时间后,应在阳极附近观察到黄绿色气体,D不正确。
本题考查电解原理。
本题难度:一般
4、选择题 镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4,下列说法错误的是( )
MgxMo3S4,下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.放电时正极反应为Mo3S4+2xe-=Mo3S42x-
C.充电时Mo3S4发生氧化反应
D.充电时阴极反应为Mg2++2e-=Mg
参考答案:C
本题解析:利用原电池工作原理可知,原电池工作时电解质溶液中阳离子移向正极,A正确;由Mg升高至+2价,结合总反应式可知共转移2x mol电子,正极得电子发生还原反应,故可知B项正确;充电时,发生氧化反应与还原反应的均为MgxMo3S4,C项错误;充电时阴极发生还原反应得到金属镁,D项正确。
点拨:本题考查原电池,考查考生的理解能力。难度中等。
本题难度:一般
5、选择题 固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。目前固体电解质在制造全固态电池及其他传感器、探测器等方面的应用日益广泛。如RbAg4I5晶体,其中迁移的物种全是Ag+,室温导电率达0.27 Ω-1·cm-1。利用RbAg4I5晶体,可以制成电化学气敏传感器。下图是一种测定O2含量的气体传感器示意图,被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是?????????????????????????????????
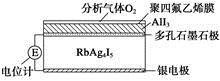
A.I2+2Rb++2e-=2RbI
B.I2+2Ag++2e-=2AgI
C.Ag-e-=Ag+
D.4AlI3+3O2=2Al2O3+6I2
参考答案:A
本题解析:电极反应式为负极:2Ag-2e-=2Ag+,正极:2Ag++I2+2e-=2AgI,O2把AlI3氧化,4AlI3+3O2=2Al2O3+6I2,A项错误。
本题难度:一般