微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关以KOH溶液为电解液的氢氧燃料电池的叙述不正确的是
A.正极反应式为:O2 + 2H2O +4e- =4OH-
B.工作一段时间后,电解液中KOH的物质的量浓度不变
C.该燃料电池的总反应式为:2H2+O2=2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.2mol电子转移
参考答案:B
本题解析:
试题分析:A、原电池中负极失去电子,正极得到电子,则氧气在正极通入,电极反应式为O2 + 2H2O +4e- =4OH-,A正确;B、工作一段时间后,溶剂水增加,因此电解液中KOH的物质的量浓度减小,B错误;C、该燃料电池的总反应式为:2H2+O2=2H2O,C正确;D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)即0.1mol氯气时,根据阳极电极反应式2Cl--2e-=Cl2↑可知有0.2mol电子转移,D正确,答案选B。
考点:考查电化学原理的应用
本题难度:一般
2、选择题 下图是氢氧燃料电池构造示意图。关于该电池说法中错误的是
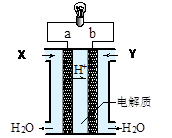
A.a极是负极
B.正极的电极反应是:O2+2H2O+4e- = 4OH-
C.电子由a通过灯泡流向b
D.通入的气体Y为O2
参考答案:B
本题解析:
试题分析:A项:从图中可以看到,H+移向b极,可知b极为负极,a极为正极,故错。C项:电子是由b通过灯泡流向a的,故错。D项:b极为负极,通入的是H2,故错。故选B。
点评:本题考查的是燃料电池的知识,解答本题先从H+的移向入手,在原电池中阳离子移向负极,即可作答本题。
本题难度:简单
3、实验题 (12分)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

(1)下列说法正确的是____________。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的c(H+)均增小
(2)在相同时间内,两烧杯中产生气泡的速度:甲____乙(填“>”、“<“或“=”)。
(3)当甲中产生1.12L(标准状况)气体时,通过导线的电子数目为_______________。
(4)当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为_________________ mol·L-1。
(5) 甲中锌片上发生的电极反应: _________________________;
(6) 若甲中两电极的总质量为60 g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为47 g,则:氢气的体积(标准状况)为________L。
参考答案:(1)BD???(2)甲>乙????(3)6.02×1022
本题解析:(1)根据装置特点可知,甲是原电池,锌比铜活泼,锌是负极,失去电子,铜是正极,溶液中的氢离子得到电子;乙不是原电池,锌能直接和稀硫酸发生置换反应,而铜不能和稀硫酸反应。所以正确的答案选BD。
(2)通过原电池反应进行的反应速率大于直接发生化学反应的反应速率。
(3)1.12L气体在标准状况下的物质的量是0.05mol,转移电子是0.05mol×2=0.1mol,数目是6.02×1022(0.1NA)。
(4)溶液中c(H+)=0.1 mol·L-1,所以氢离子的物质的量是0.1mol,因
本题难度:一般
4、填空题 (10分)如图所示的实验装置中,E为一张用淀粉、碘化钾和酚酞混合溶液润湿的滤纸,C、D为夹在滤纸两端的铂夹;x、y分别为直流电源的两极。在A、B中充满KOH溶液后倒立于盛有KOH溶液的水槽中,再分别插入一多孔的惰性电极。切断电源开关S1,闭合开关S2,通直流电一段时间后,生成气体如图所示。
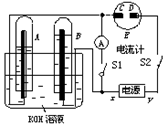
请回答下列问题:
(1)标出电源的正、负极:x为 ????。
(2)在滤纸的C端附近,观察到的现象是 ???????? ?????????????????????????? 。?
(3)写出电极反应式:B电极 ?? ? 。?
(4)若电解一段时间后,A、B中均有气体包围电极。此时切断开关S2闭合开关S1,则电流计的指针是否发生偏转 (填“偏转”或“不偏转”)。?
(5)若电流计指针偏转,写出有关的电极反应(若指针“不偏转”,此题不必回答。);
?????? ????????????????????????? ??????? 。?
若电流计指针不偏转,请说明理由(若指针“偏转”,此题不必回答) ???????。
参考答案:(10分)⑴ 正??(1分)??⑵ 滤纸变蓝 (2分) ⑶
本题解析:
试题分析:(1)惰性电极电解KOH溶液,实质就是电解水,所得产物为H2和O2。因为A试管中气体体积是B试管中的2倍,所以A中为H2,B中为O2,即A为阴极,B为阳极,所以X为正极,Y为负极。
(2)C与电源正极相连,为阳极,电极反应方程式为2I--2e-=I2,碘遇淀粉显蓝色,所以试纸变蓝。
(3)B电极是阳极,溶液中的OH-放电,电极反应式是4OH――4e-=2H2O+O2↑。
(4)如果切断S2,闭合S1,则可由A中的H2,B中的O2与KOH溶液形成H2-O2燃料电池,把化学
本题难度:一般
5、选择题 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
A.该系统中只存在3种形式的能量转化
B.装置X能实现燃料电池的燃料和氧化剂再生
C.装置Y中负极的电极反应式为:O2+2H2O+4e-=4OH-
D.装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化

参考答案:A.存在能量转化形式有太阳能、机械能、化学能、电能,则不只是
本题解析:
本题难度:一般