微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列离子方程式正确的是
A.钠跟水反应: Na+H2O=Na++OH-+H2↑
B.向AlCl3溶液中加入少量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
C.盐酸与碳酸钙反应制备二氧化碳:CO32-+2H+=CO2↑+H2O
D.硫酸溶液与氢氧化钡溶液反应:H++OH-=H2O
参考答案:B
本题解析:试题分析:A.电荷不平,正确应该是:2Na+H2O=2Na++2OH-+H2↑ 错误;B.氢氧化钠溶液少量,生成的Al(OH)3不溶解,正确;C.碳酸钙难溶,应该写成CaCO3,错误; D.硫酸溶液与氢氧化钡溶液反应,有硫酸钡生成,错误。
考点:离子方程式
本题难度:一般
2、选择题 下列反应的离子方程式正确的是
A.氢氧化铜和盐酸反应:OH-+H+=H2O
B.钠和水反应:Na+2H2O=Na++2OH-+H2↑
C.铁和稀硝酸反应:Fe+2H+=Fe2++H2↑
D.常温下,NaOH溶液和Cl2反应:2OH-+Cl2=Cl-+ClO-+H2O
参考答案:D
本题解析:
试题解析:氢氧化铜是不溶物,应保留化学式,故A错误;电荷不守恒,故B错误;稀硝酸有强氧化性,与活泼金属反应不能产生氢气,故C错误;氯气在氢氧化钠溶液中发生自身氧化还原反应,故D正确。
考点:离子方程式正误判断
本题难度:一般
3、填空题 废旧锂离子池的正极材料(主要含有LiCoO2及少量的Al、Fe等)可用于回收钴、锂,工艺流程如下:
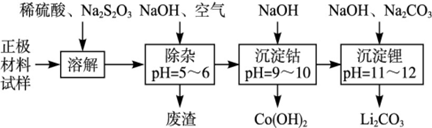
(1)在上述溶解过程中,S2O32-被氧化成SO42-,LiCoO2在溶解过程中发生反应的化学方程式为 ,还原产物是 。
(2)在上述除杂过程中,通入空气的作用是 废渣的主要成分是 。
(3)“沉淀钴”和“沉淀锂”的离子方程式分别为 。
(4)除了废渣可以回收利用外,本工艺还可回收的副产品是 。
参考答案:(1)8LiCoO2+Na2S2O3+11H2SO4=4Li
本题解析:(1)正极材料主要含有LiCoO2及少量Al、Fe等,加入稀H2SO4、Na2S2O3,S2O32-被氧化成SO42-,具有还原性,正极材料中只有LiCoO2具有氧化性,与反应Na2S2O3反应生成CoSO4,反应化学方程式为:8LiCoO2+Na2S2O3+11H2SO4=4Li2SO4+8CoSO4+Na2SO4+11H2O,该反应中还原产物是 CoSO4,
(2)弱酸性条件下,铝离子和氢氧根离子反应生成氢氧化铝沉淀,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,但氢氧化亚铁不稳定易被氧气氧化生成氢氧化铁沉淀,所以废渣的成分是氢氧化铝和氢氧化铁。通入空气的作用是将亚铁离子氧化生成铁离子而除去。
(3)根据工艺流程图可知,钴离子和氢氧根离子反应生成氢氧化钴沉淀,离子方程式为:Co2++2OH-=Co(OH)2↓,碳酸根离子和锂离子反应生成碳酸锂沉淀,2Li++CO32-=Li2CO3↓
(4)稀硫酸和氢氧化钠、硫代硫酸钠反应都生成硫酸钠,且硫酸钠是可溶性的,所以溶液中存在硫酸钠,则还可以得到副产物Na2SO4。
本题难度:困难
4、选择题 下列离子方程式中不正确的是
A.稀硫酸和氢氧化钠溶液反应:H+ + OHˉ= H2O
B.在硫酸铜溶液中加入氢氧化钡溶液 Ba2++SO =BaSO4↓
=BaSO4↓
C.金属钠投入水中 2Na + 2H2O = 2Na+ + 2OH-+ H2↑
D.氯气通入溴化钠溶液中 Cl2+2Brˉ = 2Cl-+Br2
参考答案:B
本题解析:离子方程式书写的正误判断方法和步骤归纳如下,简称“十看”。一看离子方程式是否符合客观事实;二看发生的反应能否用离子方程式表示;三看各物质拆写成离子的时候拆写是否正确;四看生成物中的“↑”和“↓”是否标注正确;五看离子方程式左右两边电荷是否守恒、质量是否守恒;六看操作顺序;七看是否漏写离子反应;八看离子的配比是否符合事实;九看过量或少量的反应物是否对产物有影响;十看氧化还原型离子反应是否遵循电子守恒。B项属于漏写离子反应,漏掉了Cu2+和OH-的反应,正确书写为:Ba2++2OH-+Cu2++SO =BaSO4↓+Cu (OH)2↓。
=BaSO4↓+Cu (OH)2↓。
本题难度:困难
5、选择题 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断正确的是(不计CO2溶解)
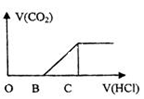
A.若OB=0,则溶液M为Na2CO3溶液
B.若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2 HCO3-
HCO3-
C.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
参考答案:C
本题解析:
试题分析:A. 若OB=0,由于加入HCl立即产生气体,说明发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑,说明溶液是NaHCO3溶液,错误;B.若OB=BC,在OB段发生反应:Na2CO3+ HCl="NaCl+" NaHCO3;在BC段发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑。溶液M是Na2CO3。则形成溶液M所发生反应的离子方程式为2OH-+CO2=HCO3-,错误;C.若3OB=BC,则溶液M的成分是NaHCO3、Na2CO3。在OB段发生反应Na2CO3+ HCl="NaCl+" NaHCO3;若Na2CO31mol发生反应消耗盐酸1mol,产生NaHCO31mol;在BC段发生反应NaHCO3+HCl=NaCl+H2O+ CO2↑。NaHCO31mol消耗盐酸1mol,由于3OB=BC,则说明在原溶液中NaHCO3的物质的量是2mol,所以c(NaHCO3)=2c(Na2CO3)。正确;D.若OB>BC,由于BC段发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑。若只是含有Na2CO3,则OB=BC,现在OB>BC,说明在OB段还发生了反应:NaOH+HCl=NaCl+H2O,则溶液M是Na2CO3、NaOH。该溶液中大量存在的阴离子为CO32-和OH-,错误。
考点:考查NaOH溶液与CO2反应产物的成分的判断的知识。
本题难度:一般