微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (9分)下列有关化学实验的操作或说法中,正确的是(填字母序号)????。
A.过滤、蒸发操作过程中都需要用玻璃棒不断搅拌液体。
B.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可
C.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低。
D.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次。
E.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
F.向2mLl0%NaOH溶液中滴入2%CuSO4溶液的4—6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有红色沉淀出现。
参考答案:BDF
本题解析:略
本题难度:简单
2、实验题 下图中的实验装置可以用于实验室制取乙炔。请填空:
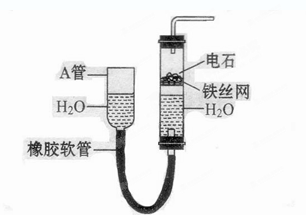
(1) 图中A管的作用是???????????????????????????????????????????????????,
制取乙炔的化学反应方程式为????????????????????????????????????????。
(2)乙炔通入酸性KMnO4溶液中,发生?????反应,可以观察到????????????????
现象,若通入溴水中,发生???????反应。
(3)乙炔燃烧的化学方程式为????????????,燃烧时的现象为????????????????,
为了安全,点燃乙炔前应该先?????????。
参考答案:(1)调节水面的高度来控制反应的发生和停止
CaC2+
本题解析:
试题分析:(1) 图中A管是可以上下移动的,所以可以通过调节水面的高度来控制反应的发生和停止。实验室制取乙炔的化学方程式是CaC2+H2O Ca(OH)2+
Ca(OH)2+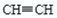 ↑。
↑。
(2)乙炔含有碳碳三键,能被酸性高锰酸钾溶液氧化,也能和溴水发生加成反应,所以乙炔通入酸性KMnO4溶液中,发生氧化反应,可以观察到紫色酸性高锰酸钾溶液逐渐褪色;若通入溴水中,发生加成反应。
(3)乙炔是可燃性气体,点燃前相应检验乙炔的纯度。由于乙炔中含碳量高,所以燃烧时有黑色浓烟生成,反应的化学方程式是2HCH2+5O2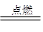 4CO2+2H2O。
4CO2+2H2O。
点评:该题是基础性试题的考查,难度不大。试题贴近教材,基础性强,旨在巩固学生的基础,提高学生的应试能力。明确乙炔的实验室制备原理、乙炔的结构特点和性质特点,是答题的关键。
本题难度:一般
3、实验题 下面是某学习小组对乙二酸的某些性质进行研究性学习的过程:
【研究课题】探究乙二酸的某些性质
【查阅资料】乙二酸(HOOC-COOH)俗称草酸,其主要物理常数如下:
名称
| 乙二酸
| 乙二酸晶体
|
分子式
| H2C2O4
| H2C2O4·2H2O
|
颜色状态
| 无色固体
| 无色晶体
|
溶解度(g)
| 8.6(20℃)
| —
|
熔点(℃)
| 189.5
| 101.5
|
密度(g·cm-3)
| 1.900
| 1.650
又知草酸在100℃时开始升 华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题: 华,157℃时大量升华,并开始分解。草酸钙不溶于水。根据上述材料提供的信息,回答下列问题:
【提出猜想】
[猜想一]根据草酸晶体的组成对其分解产物进行猜想
[设计方案]
(1)该小组同学猜想其产物为CO、CO2和H2O,并设计了探究实验,实验装置如下(草酸晶体分解装置略)。
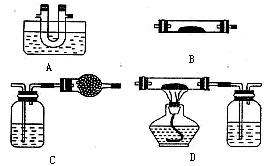
限选试剂:澄清石灰水、冰水混合物、碱石灰、氧化铜、无水硫酸铜(已知草酸蒸气也可使澄清石灰水变浑浊,草酸蒸气在低温下可冷凝为固体)。请回答下列问题:
①B装置中所装药品为?????????????????,
② CO2的检验装置是?????(填上面装置编号,下同),CO的检验装置是??????????。
③装置A的作用是????????????????????????????????????????????????。
[猜想二]乙二酸具有弱酸性
[设计方案]
(2)该小组同学为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是???????(填字母)。
A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色
B.测定相同浓度的草酸和硫酸溶液的pH
C.测定草酸钠(Na2C2O4)溶液的pH
D.将草酸溶液加入Na2CO3溶液中,有CO2放出
[猜想三]乙二酸具有还原性
[设计方案]
(3)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪色,从而判断草酸具有较强的还原性。配平该反应的离子方程式:
??MnO4- + ???H2C2O4 + ???H+ = ???Mn2+ + ???CO2↑+ ???H2O
(4)利用上述原理可定量测定某草酸晶体样品中H2C2O4·2H2O的含量,方法是:称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中H2C2O4·2H2O的质量分数为??????????????。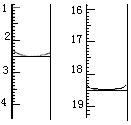
参考答案:(1)①无水硫酸铜?② C?? D?
③ 除去生成物中
本题解析:略
本题难度:一般
4、选择题 下列描述中,符合化学科学的是[???? ]
A.“纯碱”就是碱
B.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
C.“玉不琢不成器”、“百炼方能成钢”的说法都与物质的化学变化无关
D.“曾青得铁则化为铜”中的“曾青”是指青铜
参考答案:B
本题解析:
本题难度:简单
5、实验题 (10分)某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为___________________________________。
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”),请配平该反应的离子方程式:
____ MnO4– + ____ H2C2O4 + ____ H+ =" ____" Mn2+ + ____ CO2↑ + ____ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):

实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红色。据此回答:
上述装置中,D的作用是__________________.
乙二酸分解的化学方程式为______________________________________.
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化)。则下列关系合理的是????????
A.c(Na+)+c(H+)=c(HC2O4—)+c(OH—)+c(C2O42-)???
B.c(HC2O4-)+c(C2O42-)="0.2" mol·L-1
C. c(HC2O4-)>c(C2O42—)>c(H2C2O4)
D.c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42—)
参考答案:(1)HCO3– + H2C2O4 = HC2O4–+ CO
本题解析:
试题分析:(1)无色气泡为二氧化碳。HCO3– + H2C2O4 = HC2O4–+ CO2↑+ H2O
(2)酸性KMnO4为强氧化剂,褪色说明乙二酸具有还原性。由得失电子守恒和元素守恒配平。
(3)氢氧化钠的作用为除去混合气体中的CO2,装置C、G中澄清石灰水变浑浊,说明有二氧化碳,B中CuSO4粉末变蓝,说明有水蒸气,F中CuO粉末有黑色变为红色,说明有一氧化碳,分解方程式:CO2H2C2O4 H2O+CO↑+CO2↑????(4)反应后成酸性,可得 c(HC2O4-)>c(C2O42—)>c(H2C2O4),又由阴阳离子电荷守恒;c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42—). H2O+CO↑+CO2↑????(4)反应后成酸性,可得 c(HC2O4-)>c(C2O42—)>c(H2C2O4),又由阴阳离子电荷守恒;c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42—).
点评:本题是一道实验探究题,考查学生分析和解决问题的能力,注意平时只是的积累是解题的关键,综合性较强,难度大.
本题难度:一般
|