微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分) 某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
某研究性小组借助A-D的仪器装置(可以重复使用)完成有关实验
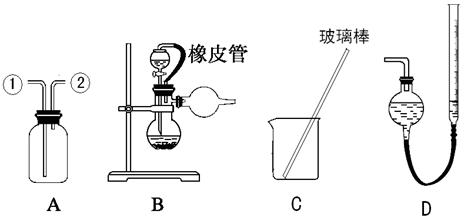

 【实验一】收集NO气体。
【实验一】收集NO气体。
 (1)用装置A收集NO气体,正确的操作是???????(填序号)。
(1)用装置A收集NO气体,正确的操作是???????(填序号)。
 a.从①口进气,用排水法集气????????? b.从①口进气,用排气法集气
a.从①口进气,用排水法集气????????? b.从①口进气,用排气法集气
 c.从②口进气,用排水法集气????????? d..从②口进气,用排气法集气
c.从②口进气,用排水法集气????????? d..从②口进气,用排气法集气
 【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
【实验二】净化用浓盐酸与KMnO4反应得到的Cl2。
(2)请参照装置A,画出净化Cl2装置图,标明所盛的药品,标注气体的流动方向。
【实验三】为了探究镀锌薄铁板上的锌的质量分数w(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑ 据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1 g。用NaOH溶液作试剂,拟出下列实验方案并进行相关实验。
 方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
方案甲:通过测量试样与碱溶液反应生成的氢气体积来实现探究目标。
(3) 选用???????和?????????(填仪器标号)两个装置进行实验。
选用???????和?????????(填仪器标号)两个装置进行实验。
(4) 测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=???????。
测得充分反应后生成氢气的体积为VL(标准状况),w(Zn)=???????。
(5) 计算镀层厚度,还需要检索的一个物理量是??????????????。
计算镀层厚度,还需要检索的一个物理量是??????????????。
(6) 若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将????(填“偏大”、“偏小”或“无影响”)。
若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将????(填“偏大”、“偏小”或“无影响”)。
 方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g ;
;
(7)w(Zn)=???????。
参考答案:(1)C?
(2)(4分)
 本题解析:略
本题解析:略
本题难度:一般
2、填空题 (11分)某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
背影资料:
交流卡片
主题:Zn、Cu与浓盐酸间的实验
A将锌放入浓盐酸的实验
B将锌片铜片贴在一起,一同放入浓盐酸中,反应快速放出气体
C当实验B中锌片完全溶解后,将溶液加热,又产生大量气体,得到无色溶液
D将实验C反应后的溶液隔绝空气,加入适量水,出现白色沉淀
?
??
资料卡片
主题;生成一价铜的反应
4CuO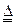 2Cu2O+O2↑ 2Cu2O+O2↑
2Cu2++4I-=2CuI(白色)↓+I2
氯化亚铜(CuCl)在不同浓度的KCl溶液中可形成[CuCl4]2-等无色离子。
?
??
请你参与以下探究:
(1)实验A反应速度明显比B小,原因是??????????????????????????????。
(2)根据“铜位于金属活动顺序表氢之后,与稀盐酸不反应,而在实验中加热时又产生气体”的事实,作出如下推断:
①有同学认为“实验C中加热时产生的气体是溶解在溶液中的H2”,你认为是否有道理,理由是?????????????????????????????????????????????。
②某同学作了如下猜想:是否成立?请你设计实验方案加入验证。
猜想
| 验证方法
| 预测现象及结论
| 认为铜片中可能含有锌等杂质
| ?
| ?
??(3)某同学对实验D中的白色沉淀进行分析:“不可能是CuCl2,因为CuCl2能溶于水且溶液显蓝色;也不可能是ZnCl2,因为稀释后溶液更稀,不会析出ZnCl2晶体。若利用资源卡片资料大胆猜想,白色沉淀可能是CuCl。请你帮他设计验证方案(若有多处方案,只设计两个)。
猜想
| 预计验证方法
| 猜想的现象与结论
| 白色沉淀是氯化亚铜
| ?
| ?
| ?
| ?
??(4)指导老师肯定了实验D中的白色沉淀是CuCl;并措出生成沉淀的原因,实际上是[CuCl4]2等离子与CuCl(s)、Cl三者之间所形成的沉淀溶解平衡移动的结果。请写出这一平衡关系式(用离子方程式表示):???????????????????????????????。
参考答案:.(11分)
(1)铜锌及浓盐酸一起组成了原电池,加快
本题解析:略
本题难度:一般
3、选择题 下列有关化学研究的正确说法是[???? ]
A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律
B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同
C.依据丁达尔现象可将分散系分为溶液、胶体与浊液
D.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
参考答案:B
本题解析:
本题难度:一般
4、实验题 (8分)按图中所示装置,用两种不同操作分别进行实验.回答有关问题:

(1)按图示连接好装置,打开止水夹a,在B中可观察到的现象是:________,A中发生反应的化学方程式是?????????????;
(2)反应片刻后,夹紧止水夹a,此时可观察到的现象有:________,B中发生反应的离子方程式是:________。
参考答案:(8分)?(1) _ 有气泡放出__, _Fe+H2SO4=
本题解析:
本题需要明确的是:当B中的空气未排净时,NaOH与FeSO4反应后的产物Fe(OH)2只能短暂存在,随即使O2氧化;当通入H2一段时间后,即认为B中的空气已排净,生成的Fe(OH)2能较长时间保存。
答案:操作1:容器A中的液体进入容器B,容器B中有白色沉淀生成,沉淀逐渐变为灰绿色,一段时间后变为红褐色
Fe2++2OH- Fe(OH)2↓ 4Fe(OH)2+O2+2H2O Fe(OH)2↓ 4Fe(OH)2+O2+2H2O 4Fe(OH)3 4Fe(OH)3
操作2:开始时容器B中的导管口有气泡冒出,夹紧止水夹a后容器A中的液体进入容器B,B中有白色沉淀生成。
本题难度:一般
5、实验题 (5分)硫代硫酸钠溶液与稀硫酸的反应方程式为:
Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O,
某实验兴趣小组用如下图所示的实验装置探究外界条件对化学反应速率的影响(加热仪器和夹持仪器均已省略)。
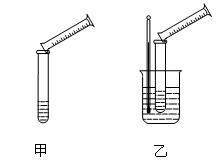
(1)实验目的:装置甲,探究浓度对化学反应速率的影响;装置乙,探究???????对化学反应速率的影响。
(2)通过甲、乙装置,分别进行了三组实验,数据记录如下,并经分析得出相关结论:
实验
组号
| 温度]
| Na2S2O3溶液
| H2SO4
| 加入H2O的体积
| 出现沉淀所需时间
| 体积
| 浓度
| 体积
| 浓度
| Ⅰ
| 0℃
| 5mL
| 0.1mol·L-1
| 10mL
| 0.1mol·L-1
| 5mL
| 8s
| Ⅱ
| 0℃
| 5mL
| 0.1mol·L-1
| 5mL
| 0.1mol·L-1
| 10mL
| 12s
| Ⅲ
| 30℃
| 5mL
| 0.1mol·L-1
| 5mL
| 0.1mol·L-1
| 10mL
| 4s
结论1:由Ⅰ和Ⅱ两组数据可知 ;
结论2:由Ⅱ和Ⅲ两组数据可知?????????????????? ????????????????????。
参考答案:(5分)(1)温度(1分)
(2)其它条件一定时,反应
本题解析:略
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|