?
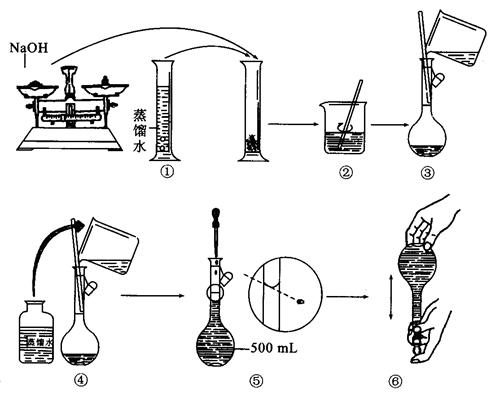
(1)填写上表中空格并从节约原料的角度来分析,你认为应选择方案_________最为合理。
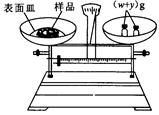
(2)本实验要用到NaOH溶液。某学生用已知质量y(g)的表面皿,准确称取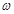 (g)NaOH固体。他在托盘天平的右盘上放入( (g)NaOH固体。他在托盘天平的右盘上放入(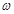 + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________???????使???????????。 + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________???????使???????????。
(3)若称取的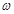 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。
(4)阅读下列制备Al(OH)3实验步骤,填写空白:
①在烧杯A中加入50mL0.5mol·L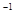 NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。 NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
②在盛有适量稀H2SO4的烧杯B中应放入___________(g)(用含m1的式子表示)质量的铝屑,充分搅拌使铝屑反应完全。
③在盛有适量浓NaOH溶液的烧杯C中放入____________(g)(用含m1的式子表示)质量的铝屑充分搅拌使铝屑反应完全。
④将烧杯B和烧杯C中的溶液混和观察到的现象是:_______________________________,反应的离子方程式是:___________________________
(5)过滤时某学生操作如图,请用文字说明图中错误的是:
_____________________???????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????????。

(6)把沉淀转移到烧杯中,用蒸馏水洗涤三次再过滤,再洗涤、
干燥得Al(OH)3固体质量为m2(g)计算本实验Al(OH)3的产率是_________________???
参考答案:
(1)
途径
生成1 mol Al(OH
本题解析:(1)根据方程式2Al+6H+=2Al3+3H2↑、Al3++3OH-=Al(OH)3↓、↓2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2-+H++H2O=Al(OH)3↓、3AlO ????4Al(OH)3↓,即可计算出消耗的氢离子或OH-的物质的量。根据消耗的原料分析,方案3是最好的。
(2)指针偏向右边,说明样品的质量还不到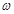 g,所以应该继续加入样品,使指针指在标尺的中间。 g,所以应该继续加入样品,使指针指在标尺的中间。
(3)考查物质的量浓度溶液的配制,溶解应该在烧杯中进行,①不正确。转移使,胶头滴管的下端应该放在刻度线的下面,③不正确。④不正确,因为没有洗涤,⑤不正确,定容时应该平视,
答案选①③④⑤。
(4)①铝片表面含有氧化铝,需要氢氧化钠除去。
②根据3AlO ????4Al(OH)3↓可知,生成铝离子的消耗的铝,和生成AlO2-消耗的铝质量之比是1︰3的,所以B中应放入 的铝。 的铝。
③根据②可知C中放入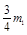 的铝。 的铝。
④铝离子和AlO2-反应生成氢氧化铝沉淀。方程式为3AlO ????4Al(OH)3↓。
(5)根据装置图可知,有2处错误,分别是玻璃棒下端应该低于滤纸边缘;漏斗颈没有(或应该)靠在烧杯内壁。
(6)m1g理论上可生成氢氧化铝是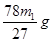 ,所以产率是 ,所以产率是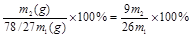 。 。
本题难度:一般
3、实验题 (13分)实验室配制500mL 0.5mol/L的NaCl溶液,有如下操作步骤:①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;②把①所得溶液小心转入500mL容量瓶中;③继续向容器瓶中加蒸馏水至液面距刻度2cm~3cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切;④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都小心转入容量瓶,并轻轻摇匀;⑤将容量瓶塞紧,充分摇匀.
(1)操作步骤的正确顺序为(填序号):_____________________________________
(2)本实验用到的基本仪器有:___________________________________________
_____________________________________________________________________
(3)若出现如下情况,所配溶液浓度将偏高、偏低,还是不变。
没有进行操作步骤④,会______;加蒸馏水时不慎超过了,会______;定容时俯视会______;若洗涤容量瓶后,有少量的水分残留在容量瓶中,会______。
(4)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应
____________________________________________________________________;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应
__________________________________________________________________。
参考答案:(1)(2分)①②③④⑤
(2)(5分)托盘天平、烧杯
本题解析:
试题分析:(1)溶液的配制过程:计算—称量(量取)—溶解(稀释)—移液—洗涤—定容—摇匀—装瓶。因此其正确的步骤为①②③④⑤。
(2)所需的基本仪器可由实验步骤联想得出:托盘天平、烧杯、玻璃棒、500 mL容量瓶、胶头滴管。
(3)对于误差的分析,应把握住基本的计算公式: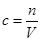 。“没有洗涤烧杯、玻璃棒”,会使得溶质的量减少,从而导致浓度偏低。“加蒸馏水时不慎超过”,会使得体积变大,从而导致溶液浓度偏低。“定容时俯视”实际体积偏小,浓度变大。“少量水残留在容量瓶中”对浓度无影响。 。“没有洗涤烧杯、玻璃棒”,会使得溶质的量减少,从而导致浓度偏低。“加蒸馏水时不慎超过”,会使得体积变大,从而导致溶液浓度偏低。“定容时俯视”实际体积偏小,浓度变大。“少量水残留在容量瓶中”对浓度无影响。
(4)在配制溶液的过程中,出错了应重新配制,否则会使配得的溶液浓度出现错误。
点评:本题以实验题的形式考查了“一定物质的量溶液的配制”问题。属于课本的基础知识。熟练掌握课本的知识,不难得出正确答案。另一方面,无论对什么题的误差分析,都应从其计算公式入手,判断操作过程中对量的大小的影响,从而判断误差偏大、偏小或者不变。
本题难度:一般
4、选择题 下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有(?????)
A.CO、O2、N2
B.HCl、Cl2、CO2
C.NH3、H2、CO
D.SO2、Cl2、O2
参考答案:A
本题解析:
试题分析:浓硫酸是强酸,还具有强氧化性,不能干燥氨气。碱石灰是氢氧化钠和生石灰的混合物,不能干燥酸性气体,例如氯化氢、氯气、CO2和SO2等,答案选A。
点评:该题是高考中的常见考点,属于基础性试题的考查。主要是考查学生对常见干燥剂以及气体性质的熟悉了解程度,旨在巩固学生的基础,提高学生的应试能力。
本题难度:简单
5、实验题 (12分) 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如右图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
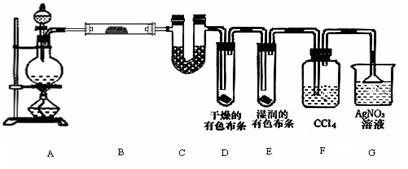
(1)写出A中发生反应的化学方程式???????????????????????????????????????。
(2)①. 装置B中盛放的试剂为?????????????,作用是???????????????????????。
②. 装置D和E中出现的不同现象说明的问题是???????????????????????????
???????????????????????????????????????????????????????????????。
③写出装置G中发生反应的离子方程式?????????????????????????????????????。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在????和????之间(填两个装置字母序号),装置中应放入?????????????(填写试剂或用品名称)。
(4)丙同学将4.48L氯气(标准状况下测定)通入到足量的石灰乳中,理论上可制得氧化产物质量
????????????g。
参考答案:(1)4HCl(浓)十Mn02  本题解析: 本题解析:
试题分析:(1)装置A是氯气的发生装置,其发生的化学方程式为:4HCl(浓)十Mn02  MnCl2+C12↑+2H2O; MnCl2+C12↑+2H2O;
(2)①由于制备氯气的过程中,会挥发出水蒸气和氯化氢气体,因此装置B、C应为除去这两种杂质气体的除杂装置。故装置B中的试剂为无水硫酸铜,所起的作用为证明水蒸气的存在。
②装置D和E的区别在于布条是否干燥,而在湿润的布条中,氯气与水反应生成次氯酸,因此这两个装置说明了“氯气无漂白性,次氯酸有漂白性”。
③装置G中发生反应的离子方程式为:Ag++Cl-=AgCl↓
(3)该装置应加在F和G之间,且装置内应装有湿润的淀粉KI试纸。
(4)标准状态下,4.48L氯气的物质的量为: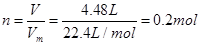 ,制得的氧化产物为Ca(Cl0)2 ,制得的氧化产物为Ca(Cl0)2
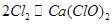
2mol???? 143g
0.2mol??? x
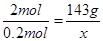 ???? ????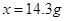
点评:本题考查了氯气的制备及其相关性质,属于中等难度的题型。解题时,应充分考虑整个实验中每一个装置所处的位置及其作用。对于实验装置的连接顺序都是一致的,为“气体发生装置—除杂装置—性质检验装置—气体收集装置—尾气处理装置”。
本题难度:一般
|