微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式??????????????????????。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向??????????????????????????。
(3)在20.00mL的0.1mol/LVO2+溶液中,加入0.195g锌粉,恰好完成反应,则还原产物可能是?????????。
a.V?????????b.V2+????????? c.VO2+??????? d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+??????????????????????????????????????????????????????????????????。
参考答案:(1)V2O5 +K2SO3+2H2SO4→2VOSO4+K
本题解析:
试题分析:(1)由题意可知,V2O5与稀硫酸、亚硫酸钾反应生成VOSO4、K2SO4,根据原子守恒可知还生成H2O。其中V的化合价从+5价降低到+4价,得到1个电子。亚硫酸钾中S元素的化合价从+4价升高到+6价,失去2个电子,因此根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:1,所以配平后方程式为V2O5+K2SO3+2H2SO4=2VOSO4+K2SO4+2H2O。
(2)ClO3-与VO2+反应生成VO2+、Cl-,氯元素化合价由+5价降低为-1价,共降低6价。V元素化合价由+
本题难度:一般
2、填空题 (12分)化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1.
则:①A+B→C+D表示的离子方程式为?????????????????????????????????????????????。
②标准状况下,若2.24L的D被100mL 2mol/L盐酸吸收,则所得溶液中各离子浓度从大到小的顺序为_???????????????????????????????????????????___.
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应.
则:①A+B→C+D表示的化学方程式为????????????????????????????????????????.
②D与NaOH溶液反应的化学方程式为___????????????????????????????????????_.
③工业上,将B、D按一定的量溶于盐酸后,继续通入气体Z,再加入NaOH溶液调节pH可得高效净水剂(化学式为CA(OH)aCl6-n ),则气体Z的作用是__????????????????????????????__,B、D的最佳物质的量之比是___???????_.
④工业上,通常第一步先用C与过量稀硫酸作用得溶液X:第二步再往溶液X中加入亚硝酸钠来制备C(OH)SO4,同时有气体NO生成,写出第二步反应的化学方程式为__???????????????__。
参考答案:(共12分)(1)① NH4+ + OH- = H2O +
本题解析:
试题分析:(1)①多核10电子微粒有如H2O、NH2-、 NH3、H3O+、CH4、NH4+,由题意可推知该离子方程式为NH4+ + OH- = H2O + NH3 ②所得溶液相当于0.1molNH4Cl和0.1molHCl的混合物,所以各离子浓度从大到小的顺序为c (Cl-) >c (H+)> c (NH4+)> c (OH-);
(2)①由题意可知,该反应为2Al+ 3FeO =3Fe? +Al2O3,②Al2O3与NaOH溶液反应的化学方程式为Al2O3?+2NaOH
本题难度:一般
3、选择题 人体不能够吸收+3价的铁元素,能够吸收的是+2价的铁元素,而天然食品中所含的铁元素大多是+3价的,为了将天然食品中的Fe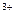 转化为Fe
转化为Fe ,可加入维生素C(VC)。下列关于维生素C的说法正确的是(?)
,可加入维生素C(VC)。下列关于维生素C的说法正确的是(?)
A.VC的氧化性比Fe 的强
的强
B.VC的还原性比Fe 的强
的强
C.VC的还原性比Fe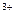 的强
的强
D.VC的氧化性比Fe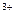 的强
的强
参考答案:B
本题解析:该变化过程(Fe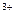 →Fe
→Fe )属于还原反应,应该选择还原剂,且所选还原剂的还原性必须强于还原产物Fe
)属于还原反应,应该选择还原剂,且所选还原剂的还原性必须强于还原产物Fe 本题难度:一般
本题难度:一般
4、填空题 (10分)
(1)在Fe3O4 +4CO 3Fe+4CO2的反应中,????????????是氧化剂,
3Fe+4CO2的反应中,????????????是氧化剂,
?????????????????是还原剂,???????元素被氧化,???????元素被还原。
(2)配平下列化学方程式并用单线桥法分析下列氧化还原反应中电子转移的方向和数目,
??Cu +?HNO3(浓)??— ??Cu(NO3)2 + ???NO2↑ +???H2O
浓硝酸表现出来的性质是_______________(填写编号)。
①还原性????????②酸性???????③氧化性
参考答案:(1)四氧化三铁、一氧化碳、碳、铁
(2)系数为1、4
本题解析:略
本题难度:一般
5、选择题 KOH是我国古代纺织业常用的洗涤剂,古代制取KOH的流程如图,在上述流程中没有涉及的化学反应类型是
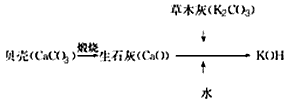 [???? ]
[???? ]
A.化合反应
B.分解反应
C.复分解反应
D.置换反应
参考答案:D
本题解析:
本题难度:简单