微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列符号代表的微粒不影响水的电离平衡的是
A.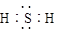
B.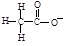
C.X3+:1s22s22p6
D.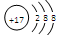
参考答案:D
本题解析:H2O H++OH-,受温度、H+、OH-、盐的弱离子的影响;H2S为酸抑制水的电离、CH3COO-、Al3+为弱离子促进水的电离;Cl—不影响水的电离平衡;
H++OH-,受温度、H+、OH-、盐的弱离子的影响;H2S为酸抑制水的电离、CH3COO-、Al3+为弱离子促进水的电离;Cl—不影响水的电离平衡;
本题难度:一般
2、选择题 H2A为二元弱酸,则下列说法正确的是
A.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
B.在等物质的量浓度的Na2A、NaHA两溶液中,前者pH大于后者
C.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+)
D.在Na2A溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
参考答案:B
本题解析:A、因为阴离子发生水解,水解后离子数目增大,故阴离子总数不等;
B、酸性H2A>HA-;越弱越水解,故前者水解程度大,碱性强。
C、因电离水解程度未知,不能判断;
D、该等式为电荷守恒,但硫离子有2个负电荷。故为 c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
本题难度:一般
3、选择题 在25℃,将pH=11的NaOH溶液a mL与pH=1的H2SO4溶液b mL混合,当恰好完全中和时,a与b的比值为
A.1000:1
B.100:1
C.50: 1
D.10: 1
参考答案:B
本题解析:因为为强酸强碱的中和故有10-3mol/L×aml=10-1mol/L×bml;故有a:b=100:1。
本题难度:简单
4、填空题 现有浓度均为0.1 mol·L-1的下列溶液:
①硫酸、②醋酸溶液、③氢氧化钠溶液、④氯化铵溶液、⑤醋酸铵溶液、⑥硫酸铵溶液、⑦硫酸氢铵溶液、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+)
B.c(Na+)=0.1 mol·L-1
C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
参考答案:(1)④②③① (2)⑦④⑤⑧ (3)A
本题解析:(1)①、②、③抑制水的电离,①中c(H+)=0.2 mol·L-1,②中c(H+)<0.1 mol·L-1,③中c(OH-)=0.1 mol·L-1,④促进水的电离,故四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①。(2)NH4HSO4溶液中,H+抑制NH4+水解,CH3COONH4溶液中,CH3COO-促进NH4+的水解,NH3·H2O是弱电解质,电离产生极少的NH4+,故四种溶液中NH4+浓度由大到小的顺序为⑦④⑤⑧。(3)NaOH溶液和NH4Cl溶液等浓度等体积混合:NaOH+NH4Cl=
本题难度:一般
5、选择题 已知:2C4H10(g)+13O2(g)===8CO2(g)+10H2O(l) ΔH=-5 800 kJ·mol-1 的叙述错误的是
A.该反应的反应热为ΔH=-5 800 kJ·mol-1,是放热反应
B.该反应的ΔH与各物质的状态有关,与化学计量数也有关
C.该式的含义为:25 ℃、101 kPa下,2 mol C4H10气体完全燃烧生成CO2 和液态水时放出热量5 800 kJ
D.该反应为丁烷燃烧的热化学方程式,则丁烷的燃烧热为5800 kJ·mol-1
参考答案:D
本题解析:
试题分析:A、根据题意得出该反应的反应热△H=-5800kJ/mol,是放热反应,正确,不选;B、反应热的与物质的状态有关,因此书写热化学方程式物质的状态必须写上,同时反应热跟方程式的系数对应,正确,不选;C、热化学方程式不仅表明了化学反应的物质的变化,也表明了化学反应的能量变化,正确,不选;D、燃烧热:在25℃、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量。C4H10系数不是1,5800 kJ·mol-1不是丁烷的燃烧热,错误,选D。
考点:考查反应热、热化学反应方程式的书写、燃烧热等相关知识。
本题难度:一般