微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是( )
A.化学反应有新物质生成,并遵循质量守恒定律和能量守恒定律
B.原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物的官能团
C.分子间作用力比化学键弱得多,但它对物质熔点、沸点有较大影响,而对溶解度无影响
D.酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对绿色化学、环境保护及节能减排具有重要意义
2、填空题
20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构。其要点可以概括为:
Ⅰ.用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数。分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间;
?Ⅱ.分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
i.孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii.X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
iV.其他。
请仔细阅读上述材料,回答下列问题:
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表

(2)请用VSEPR模型解释CO2为直线形分子的原因______________;
(3)H2O分子的立体构型为:______,请你预测水分子中∠H-O-H的大小范围并解释原因_____________;
(4)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S-Cl、S-F之间以单键结合。请你预测
SO2Cl2和SO2F2分子的立体构型:__________________,SO2Cl2分子中∠Cl-S-Cl ____(填“<”、“>”或“=”)SO2F2分子中∠F-S-F。
(5)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型
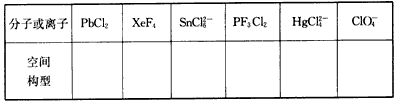
3、选择题 下列变化过程中,克服的是分子间作用力的是( )
A.烧碱溶于水
B.氯化氢气体溶于水
C.二氧化碳变成干冰
D.加热碘化氢使其分解
4、填空题 物质在下列变化过程中克服的是(填序号):①分子间作用力②共价键③离子键
(1)冰融化_________;
(2)液溴挥发________;
(3)食盐熔化________;
(4)电解熔融MgCl2制Mg________;
(5)H2S受热分解生成S和H2_______;
(6)NaHSO4溶于水_________。
5、选择题 下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是[???? ]
A.液溴和苯分别受热变为气体
B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化
D.食盐和葡萄糖分别溶解在水中