微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,再加入50 mL0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:
“ FeSO4 + KNO3 + H2SO4= K2SO4 + Fe2(SO4)3+ NxOy + H2O”,则对该反应的下列说法正确的是
A.反应中还原产物是NO
B.氧化产物和还原产物的物质的量之比为1∶4
C.反应过程中转移的电子数为8e-
D.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
参考答案:D
本题解析:
试题分析:5.6g的Fe的物质的量是0.1mol,与稀硫酸完全反应生成0.1mol FeSO4 ,再加入50 mL0.5mol·L-1 KNO3溶液,相当于溶液中存在0.025mol的硝酸,与亚铁离子恰好发生氧化还原反应,所以FeSO4 与KNO3 的系数比是0.1:0.025=4:1,0.1mol亚铁离子转化为铁离子转移电子的物质的量是0.1mol,则硝酸根离子得电子的物质的量也是0.1mol,设硝酸根离子中N的化合价降低x价,则有0.025mol×x=0.1mol,所以x=4,则硝酸的还原产物中N的化合价是+1价,因此反应中的还原产物为N2O,A错误;FeSO4 与KNO3 的系数比是0.1:0.025=4:1,氧化产物是Fe2(SO4)3,还原产物是N2O,所以氧化产物和还原产物的物质的量之比为4:1,B错误;0.1mol硫酸亚铁转移电子数目是0.1NA,C错误;根据以上分析,已知还原产物是N2O,则KNO3 的系数是2,则FeSO4 的系数应为8,K2SO4的系数是1,Fe2(SO4)3,的系数是4,N2O,的系数是1,根据元素守恒,H2SO4的系数是5,H2O的系数是5,学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5,正确,答案选D。
考点:考查氧化还原反应的分析、计算,方程式的配平
本题难度:一般
2、填空题 对反应3Cl2 + 8NH3== 6 NH4Cl + N 2
(1)该反应中的氧化剂是__________ ,被氧化的元素是 。
(2) 1 mol Cl2参加反应,被氧化的NH3的物质的量是 mol。
(3) 标出该反应中电子转移情况 。
(4) 若有68g NH3参加反应,电子转移的物质的量是 mol。
参考答案:(10分) ( 每空2分)
本题解析:
试题分析::(1)化合价升高元素是N,被氧化,所在反应物NH3是还原剂,化合价降低元素是Cl,所在反应物Cl2是氧化剂,被还原,故答案为:Cl2;N;(2)8个N有2个发生氧化反应,即3mol Cl2参加反应,被氧化的NH3的物质的量是2 mol,故1 mol Cl2参加反应,被氧化的NH3的物质的量是2/3mol。(4)在反应中,被氧化的物质是还原剂2mol的NH3,当有136g氨气参加反应时,只有四分之一被氧化,所以被氧化的NH3质量是68g/4=17g,即1mol,故电子转移的物质的量是3mol。
考点:氧化还原反应
点评:本题考查学生氧化还原反应的有关知识,可以根据所学知识进行回答,难度不大。
本题难度:一般
3、选择题 下列反应不属于氧化还原反应的是
A.3Cl2+6 KOH====5KCl+KClO3+3H2O
KOH====5KCl+KClO3+3H2O
B.2NO2+2NaOH====NaNO3+NaNO2+H2O
C.Fe2O3+2Al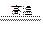 2Fe+Al2O3
2Fe+Al2O3
D.SnCl4+2H2O===SnO2+4HCl
参考答案:D
本题解析:略
本题难度:简单
4、选择题 将5.6 g铁粉放入一定量某浓度的硝酸溶液中,待铁粉全部溶解后,共收集到NO、NO2(其他气体忽略不计)混合气体0.15 mol,该混合气体中NO与NO2的体积比可能是
A.1∶2
B.2∶1
C.3∶2
D.3∶1
参考答案:A
本题解析:
试题分析:在氧化还原反应中电子转移数目相等。n(Fe)=0.1mol,若Fe反应时完全转化为Fe2+,则失去电子0.2mol;若反应时完全转化为Fe3+,则失去电子0.3mol;A.若n(NO):n(NO2)=1∶2,则n(NO)="0.05" mol,n(NO2)=0.1mol;电子转移n(e-)="0.05" mol×3+0.1mol×1="0.25" mol,介于0.2mol~0.3mol之间,既含有Fe2+。也含有Fe3+;正确;B.若n(NO):n(NO2)= 2∶1,则n(NO)= 0.1mol,n(NO2)=" 0.05" mol;电子转移n(e-)="0.1" mol×3+0.05mol×1="0.35" mol>0.3mol是不可能的,错误;C.若n(NO):n(NO2)=3∶2, n(NO)=" 0.09" mol,n(NO2)=" 0.06" mol;电子转移n(e-)="0.09" mol×3+0.06mol×1="0.33" mol>0.3mol是不可能的,错误;D.若n(NO):n(NO2)=3∶1,则n(NO)=" 0.1225" mol mol,n(NO2)=" 0.0375" mol;电子转移n(e-)="0.1225" mol×3+0.0375 mol×1="0.375" mol>0.3mol是不可能的,错误.
考点:考查Fe与一定量的硝酸发生反应产物的多少的判断的知识。
本题难度:一般
5、填空题 Ⅰ.用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为:
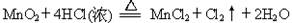
(1)该盐酸的物质的量浓度为 mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目 。
(3)8.7gMnO2能使 molHCl被氧化。
Ⅱ.在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原
的硫酸为 0.9 mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________________________________________。
参考答案:Ⅰ(1)11.9
(2) 本题解析:
本题解析:
试题分析:Ⅰ.(1)有公式c="1000pw/M=1000×1.19×36.5%/36.5=11.9" mol/L;
(2)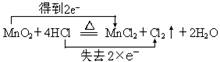
(3)在反应中MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol MnO2氧化2mol浓盐酸,所以8.7gMnO2能使0.2molHCl被氧化.
Ⅱ.已知反应 Cu+2H2SO4 CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9="1.8(mol)"
CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9="1.8(mol)"
又知,硫酸的物质的量浓度为18mol/L ;所以原体积为1.8/18=0.1L;参加反应H2SO4为0.9mol×2=1.8mol,体积100mL,因反应后稀H2SO4不与Cu反应,故H2SO4体积应大于100mL。加入硝酸盐后,相当于铜与稀硝酸反应,3Cu+8H++2NO3-=3Cu2++2NO +4H2O
考点:实验室制取氯气的反应,及铜与浓硫酸的反应
本题难度:一般