微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)

A.①<②<③<④
B.①<③<②<④
C.②<①<④<③
D.①<②<④<③
参考答案:B
本题解析:
试题分析:①总电极反应式:2Cu2++2H2O 2Cu+O2↑+4H+,阳极电极反应式:2H2O-4e-=4H++O2↑,通过0.002mole-,产生n(H+)=0.002mol,c(H+)=0.02mol·L-1;②总电极反应式:Zn+2H+
2Cu+O2↑+4H+,阳极电极反应式:2H2O-4e-=4H++O2↑,通过0.002mole-,产生n(H+)=0.002mol,c(H+)=0.02mol·L-1;②总电极反应式:Zn+2H+ Zn2++H2↑,阴极电极反应式:2H++2e-=H2↑,通过0.002mole-,消耗H+的物质的量为0.002mol,剩余H+的浓度:c(H+)=(200×10-3×0.005×2-0.002)/(200×10-3)mol·L-1=0,说明H2SO4完全反应,溶质是ZnSO4;③总电极反应式:Cu2++2Cl-
Zn2++H2↑,阴极电极反应式:2H++2e-=H2↑,通过0.002mole-,消耗H+的物质的量为0.002mol,剩余H+的浓度:c(H+)=(200×10-3×0.005×2-0.002)/(200×10-3)mol·L-1=0,说明H2SO4完全反应,溶质是ZnSO4;③总电极反应式:Cu2++2Cl- Cu+Cl2↑,氯气和水发生极少量的盐酸和次氯酸;④总电极反应式:2Cl-+2H2O
Cu+Cl2↑,氯气和水发生极少量的盐酸和次氯酸;④总电极反应式:2Cl-+2H2O Cl2↑+H2↑+2OH-,溶液显碱性,c(H+)的从大到小的顺序:①③②④,pH与c(H+)相反,pH由小到大的顺序①③②④。
Cl2↑+H2↑+2OH-,溶液显碱性,c(H+)的从大到小的顺序:①③②④,pH与c(H+)相反,pH由小到大的顺序①③②④。
考点:考查电解池的工作原理。
本题难度:困难
2、填空题 氮元素广泛存在于自然界中,对人类生命和生活具有重要意义。含氮元素的化合物在工业生产和国防建设中都有广泛的应用。
(1)氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。PH3分子的空间构型为 ,是 分子。(填极性或非极性)
(2)氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)
a.NH3比PH3稳定性强
b.硝酸显强氧化性,磷酸不显强氧化性
c.氮气与氢气能直接化合,磷与氢气很难直接化合
d.氮气常温是气体,磷单质是固体
亚硝酸盐是食品添加剂中急性毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。
(3)亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色变为绿色,反应如下,补上缺项物质并配平:
Cr2O72-+ NO2-+ → Cr3+ + NO3-+
(4)上题反应中每消耗0.6mol NO2-,转移电子数为 。
(5)氮氧化物(NO和NO2)污染环境。若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1 mol,则反应的离子方程式为 。
参考答案:(1)3 2
本题解析:
试题分析:(1)氮元素的原子序数是7,其核外电子排布为1s22s22p3,原子核外有3个未成对电子,最外层有2种能量不同的电子。PH3分子中P原子含有1对孤对电子,价电子数是4,所以其空间构型为三角锥形,是极性分子。
(2)a.非金属性越强,氢化物的稳定性越强,因此NH3比PH3稳定性强可以说明二者非金属性相对强弱,a正确;b.硝酸显强氧化性,磷酸不显强氧化性与非金属性强弱无关系,b不正确;c.非金属性越强,越容易与氢气化合,因此氮气与氢气能直接化合,磷与氢气很难直接化合可以说明二者非金属性相对强弱,c正确;d.氮气常温是气体,磷单质是固体,非金属性强弱与状态无关系,d不正确,答案选ac。
(3)根据方程式可知Cr元素的化合价从+6价降低到+3价,得到3个电子。氮元素的化合价从+3价升高到+5价,失去2个电子,所以根据电子得失守恒可知配平后的方程式为Cr2O72-+ 3NO2-+ 8H+ →2Cr3+ + 3NO3-+ 4H2O。
(4)氮元素的化合价从+3价升高到+5价,失去2个电子,所以每消耗0.6mol NO2-,转移电子数为0.6×2×NA=1.2NA。
(5)9.2gNO2的物质的量是9.2g÷46g/mol=0.2mol,反应中转移0.1mol电子,所以在反应中NO2部分不还原为亚硝酸根,另外一部分转化为硝酸根,所以反应的离子方程式为2NO2+CO32-→ NO2-+NO3-+CO2。
考点:考查核外电子排布、非金属性强弱比较以及氧化还原反应的有关应用与计算
本题难度:困难
3、选择题 下列表示物质结构的化学用语或模型正确的是(??)
A.氯原子的结构示意图:
B.甲烷分子的球棍模型:
C.氯化镁的电子式:
D.原子核内有8个中子的氧原子: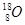
参考答案:C
本题解析:
试题分析:A不正确,氯原子的最外层电子数是7个; B不正确,该模型表示比例模型;D不正确,原子核内有8个中子的氧原子应该是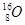 ,所以正确的答案选C。
,所以正确的答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常
本题难度:一般
4、选择题 下列化学方程式中,书写不正确的是( )
A.2Fe+6HCl=2FeCl3+3H2
B.4Al+3O2
?点燃?
.
?
2Al2O3
C.A12O3+2NaOH=2NaAlO2+H2O
D.Fe+CuCl2=FeCl2+Cu
参考答案:A.铁与盐酸反应生成的是Fe2+,不是Fe3+,原因是作为盐
本题解析:
本题难度:简单
5、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是
A.在1 L 0.1 mol/L硫化钠溶液中阴离子总数大于0.1NA
B.1 mol O2作氧化剂时转移电子数一定为4NA
C.标准状况下,22.4 L戊烷所含分子数为NA
D.在1 L 1.0 mol/L NaCl 溶液中含有NA个NaCl分子
参考答案:A
本题解析:B项,1 mol氧气和钠反应生成过氧化钠时,转移电子数是2NA,错误。C项,戊烷是液体,气体摩尔体积对其不适用,错误。D项,氯化钠中只存在离子不含分子,错误。
本题难度:一般
|