微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某温度时CH3COOH的电离平衡常数为K,该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入
0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是
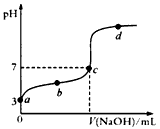 [???? ]
[???? ]
A.a点表示的溶液中c(CH3COO-)= 10-3 mol/L
B.b点表示的溶液c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中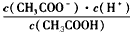 均等于K
均等于K
参考答案:C
本题解析:
本题难度:一般
2、填空题 已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;
②25℃时,2.0×10-3mol/L氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如图1所示:
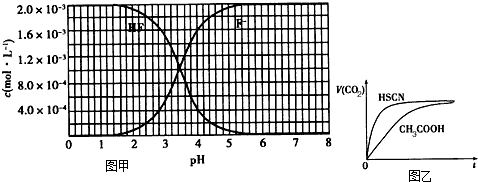
请根据以下信息回答下列问题:
(1)25℃时,将20mL0.10mol/LCH3COOH溶液和20mL0.10mol/LHSCN溶液分别与20mL0.10mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:①反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______,②反应结束后所得两溶液中,c(CH3COO-)______c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka≈______.
参考答案:(1)①反应速率与氢离子浓度成正比,硫氰酸的电离平衡常数大于
本题解析:
本题难度:简单
3、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是
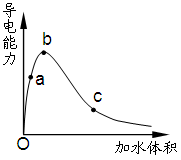
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
参考答案:BC
本题解析:根据溶液的导电能力可知,氢离子浓度由大到小的顺序是bac,所以pH由大到小的顺序是cab,A不正确;稀释促进电离,选项B正确;pH试纸如果事先润湿,则相当于稀释醋酸,由于a点随溶液的稀释氢离子浓度是增大的,所以pH会减小,C正确;醋酸在稀释过程中,醋酸的物质的量是不变的,中和氢氧化钠的能力是不变的,D不正确,答案选BC。
本题难度:一般
4、选择题  下列叙述正确的是??(??)
下列叙述正确的是??(??)
A.0.1 mol/L Na2CO3溶液中:c(Na+)>c(CO32->c(H+)>c(OH-)
B.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)前者大于后
C.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
D.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
参考答案:C
本题解析:
试题分析: Na2CO3溶液显碱性,A错误;.pH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,c(H+)相同,B错误;Ag2S的溶解度小于AgCl所以在Na2S溶液中加入AgCl固体,AgCl可以转化为Ag2S,溶液中c(S2-)下降,C正确;Kw只与温度有关与浓度无关,D错误。答案选C。
点评:本题综合性强,主要考查电离平衡的知识点,锻炼学生的分析能力。
本题难度:简单
5、填空题 (1)为了证明一水合氨是弱碱,甲、乙、丙三同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是 。
②乙同学取10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b应满足的关系是 (用等式或不等式表示)。
③丙同学取出10 mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是 ,则证明—水合氨是弱电解质。
(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 。
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)=c(H+)>c(OH-)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
(3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,则一水合氨的电离常数Kb= 。
参考答案:(1) ①如果氨水是强碱,0.10mol?L-1氨水pH为1
本题解析:
试题分析:(1)若证明一水合氨是弱碱,需从以下几个角度考虑:a、看电离程度b、看是否存在电离平衡c、测盐溶液的pH。 ①甲同学用pH试纸测得室温下0.10 mol·L-1氨水pH为10,则认定一水合氨是弱电解质,理由是如果氨水是强碱,0.10mol?L-1氨水pH为13,溶液的pH=10<13,所以一水合氨是弱碱;②若是强碱,稀释100倍,pH减小2个单位,由于一水合氨是弱碱,稀释的过程中,促进电离,c(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a;答案为:(a-2)<b<a;③如果一水合氨是弱碱,则存在电离平衡NH3·H2O  NH4+ + OH-,向氨水中加入氯化铵后,铵离子浓度增大,平衡逆向移动,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅;(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,a.氨水稍过量,混合液呈中性,c(C1-)=c(NH4+)>c(H+)=c(OH-) ,正确;b.盐酸过量,溶液为盐酸和氯化铵的混合液,溶液显酸性,c(C1-)>c(NH4+)=c(H+)>c(OH-),正确;c.氨水远远过量,溶液为氨水和氯化铵的混合液,一水合氨的电离程度大于铵离子的水解程度,溶液呈碱性,c(NH4+)>c(OH-)>c(C1-)>c(H+),正确;d.不可能出现c(OH-)>c(NH4+)>c(H+)>c(C1-),错误;选abc; (3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,NH4+的水解常数Kh=[H+][NH3·H2O]/[NH4+]=10—9,水合氨的电离常数
NH4+ + OH-,向氨水中加入氯化铵后,铵离子浓度增大,平衡逆向移动,溶液中氢氧根离子浓度降低,溶液的碱性减弱,则溶液的颜色变浅;(2)向25 mL 0.10 mol·L-l的盐酸中滴加氨水至过量,a.氨水稍过量,混合液呈中性,c(C1-)=c(NH4+)>c(H+)=c(OH-) ,正确;b.盐酸过量,溶液为盐酸和氯化铵的混合液,溶液显酸性,c(C1-)>c(NH4+)=c(H+)>c(OH-),正确;c.氨水远远过量,溶液为氨水和氯化铵的混合液,一水合氨的电离程度大于铵离子的水解程度,溶液呈碱性,c(NH4+)>c(OH-)>c(C1-)>c(H+),正确;d.不可能出现c(OH-)>c(NH4+)>c(H+)>c(C1-),错误;选abc; (3)常温下,0.10mol·L-l的NH4Cl溶液pH为5,NH4+的水解常数Kh=[H+][NH3·H2O]/[NH4+]=10—9,水合氨的电离常数
Kb=[OH-][NH4+]/[NH3·H2O]=Kw/Kh=1×10—5。
考点:考查强弱电解质的比较、酸碱混合溶液中离子浓度大小比较及电离平衡常数计算。
本题难度:困难