微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:2SO2(g) + O2(g)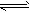 2SO3(g) △H = -196.6 kJ/mol 。现有SO2和O2各2mol,在恒温下的固定体积容器中反应,平衡时SO2的转化率为a,而在绝热密闭的同一反应容器中反应,平衡时SO2的转化率为b,则a与b的正确关系为 [???? ]
2SO3(g) △H = -196.6 kJ/mol 。现有SO2和O2各2mol,在恒温下的固定体积容器中反应,平衡时SO2的转化率为a,而在绝热密闭的同一反应容器中反应,平衡时SO2的转化率为b,则a与b的正确关系为 [???? ]
A.a > b
B.a = b
C.a < b
D.无法判断
参考答案:A
本题解析:
本题难度:一般
2、选择题 可以证明可逆反应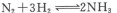 已达到平衡状态的是
已达到平衡状态的是
①一个N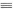 N键断裂的同时,有6个N-H键断裂
N键断裂的同时,有6个N-H键断裂
②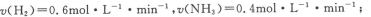
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒温恒容时,混合气体质量保持不变;[来源:]
A.②③④
B.①②④
C.①③④
D.③④⑤
参考答案:C
本题解析:
试题分析:①一个N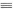 N键断裂代表正反应速率,有6个N-H键断裂代表逆反应速率,正反应速率等于逆反应速率,所以可以说明是平衡状态;②没有说明反应速率的方向,不能说明反应已经到平衡;③压强不变可以说明反应到平衡;④物质的体积分数不变可以说明到平衡;⑤因为反应要遵循质量守恒,所以混合气体的质量总不变,所以总质量保持不变,不能说明反应到平衡。所以选C。
N键断裂代表正反应速率,有6个N-H键断裂代表逆反应速率,正反应速率等于逆反应速率,所以可以说明是平衡状态;②没有说明反应速率的方向,不能说明反应已经到平衡;③压强不变可以说明反应到平衡;④物质的体积分数不变可以说明到平衡;⑤因为反应要遵循质量守恒,所以混合气体的质量总不变,所以总质量保持不变,不能说明反应到平衡。所以选C。
考点:化学平衡的标志。
本题难度:一般
3、填空题 黄铁矿(FeS2,其中S为-1价)是工业生产硫酸的重要原料。FeS2在高温下与氧气反应:
 ??
??
(1)若有1molFeS2参加反应,转移电子的物质的量为_________________。
(2)硫酸生产中,SO2催化氧化生成SO3: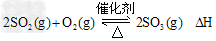
已知T℃时,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。根据图回答下列问题:
①T℃时,将2.0molSO2和1.0molO2置于10L密闭恒容反应器中,反应达平衡后,体系总压强为0.10MPa,计算该反应的平衡常数(写出计算过程,计算结果保留两位有效数字):
②T℃时,平衡由A点变到B点时,平衡常数K(A)_____K(B) (填“>”、“<”或“=”)。
③已知1g二氧化硫完全反应生成气态三氧化硫,放出热量 1.536kJ,则上述反应的反应热△H=_______________?。
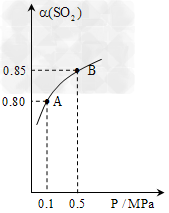
(3)某科研小组利用原电池原理,用SO2、O2和H2O来制备硫酸,装置如图,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。请问
①B电极的电极反应为__________;?
②溶液中H+的移动方向是由_____极池到_____极池(填A、B)。
参考答案:(1)10.6?mol或![]() 本题解析:
本题解析:
本题难度:一般
4、填空题 在2 L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
?
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。
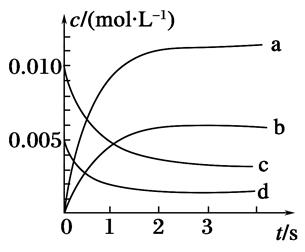
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
参考答案:(1)是 (2)b 1.5×10-3mol·(L·s)-1
本题解析:(1)该反应是可逆反应。
(2)由平衡体系2NO(g)+O2(g) 2NO2(g)知,NO2为生成物,n(NO2)=Δn(NO)=0.020mol-0.007mol=0.013mol 2NO2(g)知,NO2为生成物,n(NO2)=Δn(NO)=0.020mol-0.007mol=0.013mol
c(NO2)= 本题难度:一般 本题难度:一般
5、选择题 在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是 [???? ] bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是 [???? ]
A.a>b
B.平衡向正反应方向移动了
C.A的转化率减小了
D.B的质量分数减小了
参考答案:B
本题解析:
本题难度:一般
|