④
实验
内容

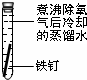

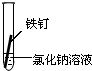
一周后观察:
(1)铁钉被腐蚀程度最大的是______(填实验序号).
(2)实验③中主要发生的是______(填“化学腐蚀”或“电化学腐蚀”).
(3)铁发生电化学腐蚀的负极反应式为:______.
(4)根据上述实验,你认为铁发生电化学腐蚀的条件是______.
(5)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上.为防护金属被腐蚀可采取的措施有______(填序号).
①健身器材刷油漆??????????????????????②自行车钢圈镀铬
③将钢管用导线与镁条连接??????????????④将钢管用导线与碳棒连接.
参考答案:(1)①在干燥空气中难以腐蚀,②隔绝空气也难以腐蚀,③④发生
本题解析:
本题难度:一般
2、选择题 家用炒菜铁锅用水清洗放置后,常出现红棕色的锈斑,在此变化过程中不发生的化学反应是( )
A.4Fe(OH)2+2H2O+O2=4Fe(OH)3
B.Fe-3e-=Fe3+
C.2Fe+2H2O+O2=2Fe(OH)2↓
D.2H2O+O2+4e=4OH-
参考答案:A、氢氧化亚铁不稳定,易被氧气氧化为氢氧化铁,即4Fe(OH
本题解析:
本题难度:一般
3、填空题 (8分)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放NaOH溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极。
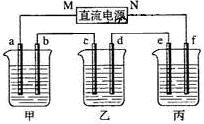
接通电源,经过一段时间后,测得乙中c电极质量增加了16g。据此回答下列问题:
(1)电极b上发生的电极反应为??????????????????????????????????;
(2)计算电极e上生成的气体在标准状态下的体积:?????????????????;
(3)电解后甲溶液的pH?????????(填“增大”、“减小”或“不变”),简述其原因:????????????????????????????????????????????????????;
(4)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
???????????????????????????????????????????????????????????。
参考答案:
(1)4OH--4e-=2H2O + O2↑(2分)
本题解析:(1)乙中c电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O + O2↑。
(2)当乙中有16gCu析出时,转移的电子为0.5mol。而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的。丙中为K2SO4,相当于电解水,由方程式2H2O 本题难度:一般 本题难度:一般
4、选择题 下列关于铁制品保护措施的说法中不正确的有( )
A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油
B.在海轮的外壳上常焊有锌块,且定期更新
C.相同条件下,马口铁(表层镀锡)与白铁(表层镀锌)相比,马口铁更为耐用
D.将不锈钢制成刀具和餐具,有的刀具还进行烤蓝处理
参考答案:A.在自行车钢圈上镀上一层金属铬,摩擦部位加上机油或黄油,阻
本题解析:
本题难度:简单
5、选择题 被称为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。总反应的化学方程式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3,下列说法错误的是(???)
A.电池工作时,锌失去电子
B.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
C.电池工作时,电子由正极通过外电路流向负极
D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-
参考答案:C
本题解析:
试题分析:在纸质电池中镀锌一边为负极,镀二氧化锰一边为正极。电池工作时A.电池工作时,锌失去电子产生的Zn2+与OH-结合产生Zn(OH)2。正确。B.由方程式可看出:1摩尔Zn反应,转移电子2摩尔。即外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g。正确。C电池工作时,电子由负极通过外电路流向正极。错误。D.电池正极的电极反应式为:2MnO2+H2O+2e-= Mn2O3+2OH-,负极的电极反应式为:Zn-2e-+2OH -= Zn(OH)2.正确。
本题难度:一般
|