微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (7分)在KClO3+6 H Cl(浓)=KCl+3Cl2↑+3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数比是____________,氧化产物与还原产物的质量比是________,反应中被氧化的盐酸和未被氧化盐酸的质量比是 ,
试用双线桥法表示上述氧化还原反应_________________________
参考答案:(7分)KClO3,Cl2, 1∶1, 5∶1, 5∶1,(
本题解析:略
本题难度:一般
2、选择题 下列变化中,必须加入氧化剂才能发生的是( )
A.SO2→S
B.SO32-→SO2
C.Fe2+→Fe3+
D.HCO3-→CO32-
参考答案:C
本题解析:
试题分析:必须加入氧化剂才能发生的反应,本身一定是还原剂,还原剂在反应过程中失去电子,化合价升高,符合这个条件的只有C。。
考点:考查还原剂的性质。
本题难度:一般
3、填空题 (8分)(1)(3分)下列各组物质中: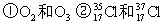 ③H2O和 D2O ④ CH3CH3和CH3CH2CH2CH3 ⑤ CH3-CH2-OH和CH3-O-CH3
③H2O和 D2O ④ CH3CH3和CH3CH2CH2CH3 ⑤ CH3-CH2-OH和CH3-O-CH3
互为同位素的是;____ __; 互为同素异形体是:____ __;
互为同分异构体是:___ ___。
(2)(5分)利用氧化还原反应原理配平以下化学方程式,并填空:
FeSO4 + KNO3 + H2SO4 === K2SO4 + Fe2(SO4)3 + NO↑+ H2O
①氧化产物为
②当电子转移了0.3mol时,有 g氧化剂参加反应
参考答案:(1)②;①;⑤(各1分)
(2)6 FeSO4 +
本题解析:(1)同位素的定义:质子数相同而中子数不同的同一元素的不同核素,即同位素的研究对象是原子;
同素异形体的定义:同种元素形成的性质不同的单质,即同素异形体的研究对象是单质;
同分异构体的定义:分子式相同而结构不同的化合物,即同分异构体的研究对象是化合物;
(2)利用化合价升降相等:Fe由+2价升高到+3价,N由+5价降低到+2价,
则(3-2)×6=(5-2)×2,即FeSO4系数为6,Fe2(SO4)3系数为3,KNO3、NO系数均为2;再利用K原子守恒,得K2SO4系数为1;再利用S原子守恒,得H2SO4系数为4;再利用H原子守恒,得H2O系数为4;最后,可利用O原子守恒检查配平是否正确;
①Fe元素由+2价升高到+3价,被氧化,得氧化产物Fe2(SO4)3;
②N元素由+5价降低到+2价,被还原,做KNO3氧化剂,在方程式中转移了6个电子,
即:2 KNO3 — 6e-
2 6
n(KNO3) 0.3mol,得:n(KNO3)="0.1" mol,则m(KNO3)=" 0.1" mol×101g.mol-1=10.1g
本题难度:一般
4、选择题 有Fe2+、NO—3、Fe3+、NH+4、H2O和H+六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.氧化剂与还原剂的物质的量之比为8:l
B.若有l mol NO—3参加还原反应,则转移8mol e-
C.还原产物为NH+4
D.若把该反应设计为原电池,则负极反应为Fe2+—e—=Fe3+
参考答案:A
本题解析:
试题分析:Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒属于一个氧化还原反应,Fe3+虽有氧化性,但与H+、NO3-的强氧化性无法比.Fe2+作还原剂,NO3-作氧化剂.由此得出该反应为:8Fe2++NO3-+10H+=8Fe3++NH4++3H2O。A.根据氧化还原反应的规律:升失氧,降得还;若说剂正相反.氧化剂是NO3-,1molNO3-生成1molNH4+,N化合价从+5降为-3,得到8mol电子;还原剂是Fe2+,8molFe2+生成8molFe3+,失去8mol电子.氧化剂与还原剂的物质的量之比为1:8.故A错误;B.根据(氧化剂)降(化合价降低) 得(得到电子) 还(发生还原反应),对应产物为还原产物.NO3-生成NH4+,N化合价从+5降为-3,NH4+为还原产物.故B正确;C.氧化剂是NO3-,1molNO3-生成1molNH4+,N化合价从+5降为-3,得到8mol电子,发生还原反应,被还原,故C正确;D.原电池的负极发生氧化反应.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+,负极反应是Fe2+失去电子,发生氧化反应.故D正确。
考点:本题考查氧化还原反应原理、原电池原理。
本题难度:一般
5、选择题 下列类型的反应,一定发生电子转移的是
A.化合反应
B.置换反应
C.复分解反应
D.分解反应
参考答案:B
本题解析:
试题分析:A、化合反应中不一定有元素化合价的变化,如二氧化碳与水化合生成碳酸,则没有电子的转移,故A错误;B、置换反应中肯定有单质参加反应,有单质生成,则一定属于氧化还原反应,即一定有电子转移,故B正确;C、分解反应中不一定有元素化合价的变化,如碳酸氢铵分解,则没有电子的转移,故C错误;D、复分解反应中是物质相互交换成分,如盐酸与氢氧化钠中和反应,则一定没有化合价的变化,即一定没有电子转移,故D错误;故选:B。
考点:考查基本反应类型和氧化还原反应的关系
本题难度:一般