微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关实验的叙述中,合理的是
A.把SO2通入紫色石蕊试液,可验证SO2的漂白性
B.构成如图所示装置时,盐桥中的K+向左池移动
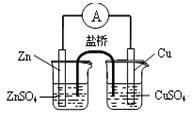
C.配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会使所配溶液浓度偏高
D.将l0 克 ZnSO4·7H2O溶解在90克水中配制10%的ZnSO4溶液
参考答案:C
本题解析:
试题分析:A、二氧化硫溶于水生成亚硫酸溶液显酸性,因此把SO2通入紫色石蕊试液,不能验证SO2的漂白性,有关通入到品红溶液中,A不正确;B、原电池中阳离子向正极移动,锌的金属性强于铜,锌是负极,铜是正极,则盐桥中的K+向左池移动,B不正确;C、配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,则容量瓶中溶液的体积偏少,则会使所配溶液浓度偏高,C正确;D、将l0 克 ZnSO4·7H2O溶解在90克水中所得溶液中溶质的质量小于10g,因此配制的ZnSO4溶液浓度小于10%,D不正确,答案选C。
本题难度:一般
2、填空题 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:

(1)A中反应的离子方程式为 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“升高”“降低”或“不变”)。
(3)C中被氧化的金属是 ,总反应式为 。
参考答案: (1)Fe+2H+ 本题解析:
本题解析:
试题分析:本题考查原电池的综合应用。A烧杯不符合原电池条件,属于金属与酸的反应;B、C装置构成了原电池,金属活动性:Zn>Fe>Sn,所以B中Fe为负极,被氧化;C中Zn为负极,被氧化。B烧杯中Fe失去电子,电子通过导线流向Sn极,Sn极上有气体产生,H+浓度降低,pH升高。
考点:原电池
本题难度:一般
3、选择题 如图为番茄电池,下列有关说法中不正确的是
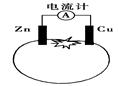
A.一段时间后,铜电极附近会出现蓝色
B.一段时间后,锌片质量会变少
C.锌电极是该电池的负极
D.电流由铜通过导线流向锌
参考答案:A
本题解析:
试题分析:A.一段时间后,铜电极是正极,不会参加反应,错误。B.由于锌片是负极要溶解,质量会变少,正确。C.锌电极是该电池的负极,正确。D.应该是电子由铜通过导线流向锌,错误。
本题难度:一般
4、填空题 (10分)下图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
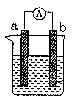
(1)当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池的总的离子反应反应方程式:
正极的电极反应式为:
当a极溶解的质量为5.4g时,有 mol电子通过导线
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,
该装置 (填“能”或“不能”)形成原电池,
若不能,请说明理由 (若能该空不作答),
若能,该原电池的正极为 ;该原电池总的化学反应方程式为:
参考答案:(10分)
(1)2Al + 6H+ ===2Al3+
本题解析:略
本题难度:简单
5、选择题 原电池的正极一定是
A.化学性质较活泼的金属
B.化学性质较不活泼的金属
C.电子流出的一极
D.电子流入的一极
参考答案:C
本题解析:
本题难度:简单