微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (19分)运用化学反应原理研究碳、氮、硫等单质及其化合物的反应有重要意义;
(1)甲醇是重要的可再生燃料。已知在常温常压下:
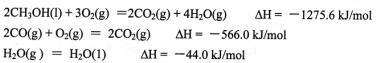
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_________。
(2)利用催化氧化反应将转化为是工业上生产硫酸的关键步骤.
①一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生上述反应,能说明该反应已达到平衡状态的是________。
a.体系的密度不发生变化
b.体系中硫元素的质量百分含量不再变化
c.SO2与SO3的体积比保持不变
d.容器内的气体分子总数不再变化
e.单位时问内转移4 mol电子,同时消耗2molSO3
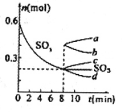
②T℃时,在1L密闭容器中充入0.6 molSO3,下图表示SO3物质的量随时间的变化曲线。达到平衡时,用SO2表示的化学反应速率为________;SO3的转化率为________(保留小数点后-位):T℃时,反应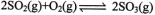 的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
的平衡常数为_______;T℃其他条件不变,在8min时压缩容器体积至0.5 L,则n(SO3)的变化曲线为________(填字母)。
(3)有人设想以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。
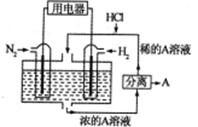
电池正极的电极反应式是_____电解质溶液的pH______(填写增大、减小、不变),A.物质是______(写化学式)。
参考答案:(1)CH3OH(l)+O2(g)=CO(g)+2H2O(l
本题解析:
试题分析:(1)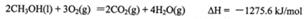 ①
①
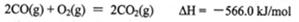 ②
②
 ③
③
ΔH=(①-②+4③)/2=(-1275.6+566.0-4×44.0)/2=-442.8kJ/mol
故热化学方程式为CH3OH(l)+O2(g)=CO(g)+2H2O(l)ΔH=-442.8kJ/mol
(2)①证明反应达到平衡状态的标志是各组分物质的量、物质的量浓度、体积分数、分子总数等不随时间的变化而变化,故选择cd。
②由图可知,当t=8min时反应达到平衡,那么v(SO3)=v(SO2)=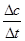 =
=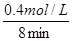 =0.05mol/(L?min)
=0.05mol/(L?min)
ω= =
= =66.7%
=66.7%
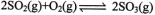
始000.6
转0.40.20.4
平0.40.20.2K=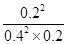 =1.25L/mol
=1.25L/mol
在8min时,压缩容器体积至0.5L,相当于增大压强,平衡向体积缩小的方向移动,即平衡向着生成SO3的方向移动,所以选择曲线c。
(3)以N2和H2为反应物,以溶有A物质的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,由图可知H2为负极,N2为正极,正极的电子,电极反应为N2+8H++6e-=2NH4+;由于H+被消耗,pH值增大;正极产生NH4+,与电解质溶液中的Cl-相结合,形成NH4Cl。
考点:热化学方程式的书写,化学反应速率与化学平衡,原电池的相关知识
本题难度:困难
2、填空题 (15分)已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g) Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T(K)
| 938
| 1100
|
K
| 0.68
| 0.40
①写出该反应平衡常数的表达式__________。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量_____;充入氦气,混合气体的密度____(选填“增大”、“减小”、“不变”)。
(2)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| C6H5ONa
| pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 11.3
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 ;
将各溶液分别稀释100倍,pH变化最小的是 (填编号)。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2NaClO=Na2CO3+2HClO D.CO2+H2O+2C6H5ONa=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(3)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 ;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 。
参考答案:⑴ ①k= 本题解析: 本题解析:
试题分析:(1)①该反应平衡常数的表达式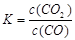 ;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO32-与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO32-。③发生反应时应该是强酸制取弱酸。A.酸性CH3COOH> H2CO3,正确。B.酸性CH3COOH> HCN.正确。C. H2CO3>HClO。正确。D.由于酸性:H2CO3>C6H5OH> HCO3-,所以会发生反应CO2+H2O+C6H5ONa=NaHCO3+C6H5OH。错误。④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO。(3)c (Cu2+)·c2(OH-)≥Ksp=2×10-20; c2(OH-)≥2×10-20÷0.02=1×10-18; c(OH-)≥1×10-9;所以pH=5; c(Cu2+)= 0.2 mol/L÷1000=2×10-4mol/L,则c2(OH-)≥2×10-20÷2×10-4mol/L=1×10-16,所以c(OH-)≥1×10-8;pH=6. ;②由于温度升高,化学平衡常数减小。说明升高温度,平衡逆向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应。若升高温度,平衡逆向移动,气体的质量减小,而气体的物质的量不变,所以混合气体的平均相对分子质量减小;充入氦气,化学平衡不发生移动,但在整个容器内气体的质量增大,所以混合气体的密度增大;(2)①同种浓度的离子结合质子能力越强,则盐水解程度就越大,盐溶液的碱性就越强,即pH越大。由于Na2CO3溶液的pH最大,说明CO32-与H+结合力最强。因此上述盐溶液中的阴离子,结合质子能力最强的是CO32-。③发生反应时应该是强酸制取弱酸。A.酸性CH3COOH> H2CO3,正确。B.酸性CH3COOH> HCN.正确。C. H2CO3>HClO。正确。D.由于酸性:H2CO3>C6H5OH> HCO3-,所以会发生反应CO2+H2O+C6H5ONa=NaHCO3+C6H5OH。错误。④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为:2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO。(3)c (Cu2+)·c2(OH-)≥Ksp=2×10-20; c2(OH-)≥2×10-20÷0.02=1×10-18; c(OH-)≥1×10-9;所以pH=5; c(Cu2+)= 0.2 mol/L÷1000=2×10-4mol/L,则c2(OH-)≥2×10-20÷2×10-4mol/L=1×10-16,所以c(OH-)≥1×10-8;pH=6.
考点:考查化学平衡常数的表达式、温度对化学平衡移动的影响、盐的水解规律、离子方程式的书写、沉淀溶解平衡的应用的知识。
本题难度:困难
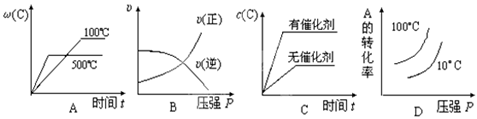
3、选择题 对于可逆反应:2A(g)+B(g) 2C(g);△H<0,下列各图中正确的是( ) 2C(g);△H<0,下列各图中正确的是( )
参考答案:A
本题解析:
试题分析:A、该反应为放热反应,温度升高平衡向逆反应方向移动,C的质量分数减小,故A正确;B、根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C、催化剂同等程度地改变正逆反应速率,平衡不发生移动,故C错误;D、该反应为放热反应,温度升高平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误,故选A。
考点:考查外界条件对平衡状态、反应速率的影响以及化学平衡图象
本题难度:一般
4、选择题 在一密闭容器中充人4 mol SO2和一定量O2,发生反应:
 2SO2(g)+O2(g)2SO3(g)△H=一196.6 kJ·mol-1。 2SO2(g)+O2(g)2SO3(g)△H=一196.6 kJ·mol-1。
则下列说法正确的是 ( )
A.为提高反应速率和SO2的转化率选择更高效的催化剂
B.增大压强有利于SO2转化,平衡常数也会增大
C.当放出353.6 kJ热量时,SO2的转化率接近90%
D.右图中纵坐标y为SO3的含量
参考答案:C
本题解析:略
本题难度:一般
5、填空题 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放
100mL 6mol/L的HCl溶液,烧杯乙中盛放100mL冷水。现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25g NH4NO3固体,搅拌使之溶解。
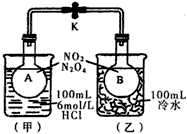
(1)A瓶中气体颜色______________,理由是__________________________。
(2)B瓶中气体颜色______________,理由是__________________________。
参考答案:(1)加深;酸碱中和反应放出热量,使平衡2NO2![]()
本题解析:
本题难度:一般
|
|