微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 影响化学反应速率的因素很多。在下列事实中,影响反应速率的外界条件分别为:
(1)夏天的食品易霉变,冬天不易发生该现象??????????;
(2)在5﹪的H2O2溶液中加入1滴~2滴1mol∕LFeCl3溶液,很快产生气体 ?????????;
(3)工业上常将固体燃料粉碎,以提高燃烧效率????????;
(4)硫在氧气中比在空气中燃烧更快?????????????;
(5)工业合成氨通常要在高压下进行???????????。
参考答案:(每空2分)(1)温度 (2)催化剂 (3)反应物固体表面积
本题解析:
试题分析:(1)夏天温度高,食物的腐烂速度加快。
(2)在双氧水的分解反应中氯化铁起到催化剂的作用。
(3)增大固体的接触面积可以加快反应速率。
(4)增大反应物的浓度可以加快反应速率。
(5)有气体参加的化学反应,增大压强可以加快反应速率。
点评:该题是高考中的常见题型,属于常识性知识的考查。试题贴近高考和生活,紧扣教材,注重答题的灵活性,有利于调动学生的学习兴趣,提高学生的应试能力。该题的关键是明确外界条件是如何影响反应速率的以及适用范围,然后结合题意灵活运用即可
本题难度:一般
2、填空题 (6分)(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择 (填序号)。
①1mL 0.01 mol·L—1的碘水 ②1mL 0.001 mol·L—1的碘水
③4mL 0.01 mol·L—1的Na2S2O3溶液 ④4mL 0.001 mol·L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算υ(S2O32—)=
参考答案: (1)②③④(3分)(各1分,少1扣1,错1全扣)
本题解析:(1)考查外界条件对反应速率的影响。根据反应的方程式可知,如果选择①,则在④中,Na2S2O3是不足的,碘水是过量的,因此溶液不褪色,正确的答案选②③④。
(2)根据方程式可知,消耗Na2S2O3的物质的量浓度是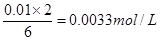 ,所以υ(S2O32—)=
,所以υ(S2O32—)=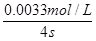 =8.3×10—4mol·L—1·s—1。
=8.3×10—4mol·L—1·s—1。
本题难度:一般
3、填空题 超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO2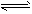 CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表
CO2+N2。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表
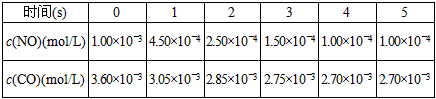
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的△H___________0(填写“>”、“<”、“=”)。
(2)前2s内的平均反应速率v(N2)=______________。
(3)在该温度下,反应的平衡常数K=________________。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是________________。
A.选用更有效的催化剂 B.升高反应体系的温度 C.降低反应体系的温度 D.缩小容器的体积
研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

|
(5)请在上表空格中填入剩余的实验条件数据。
(6)请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。
参考答案:(1)<
(2)1.88×10-4mol/L/s
本题解析:
本题难度:一般
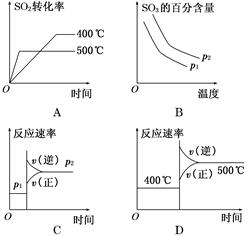
4、选择题 可逆反应2SO2(g)+O2(g)??2SO3(g),根据下表中的数据判断下列图像错误的是( )
压强
转化率
温度
| p1(MPa)
| p2(MPa)
|
400℃
| 99.6
| 99.7
|
500℃
| 96.9
| 97.8
?
参考答案:C
本题解析:从表中数据可知,升高温度,转化率降低,故正反应放热,ΔH<0;增大压强,平衡正向移动,转化率增大,故有p1<p2;A项,温度越高,反应速率越快,转化率越小,正确;B项,温度升高,平衡逆向移动,SO3百分含量降低,增大压强,平衡正向移动,SO3的百分含量升高,正确;C项,增大压强,正逆反应速率均增大,平衡向正向移动,故v(正)>v(逆),错误;D项,升高温度,正逆反应速率均增大,平衡逆向移动,正确。
本题难度:一般
5、填空题 (14分)
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号
| 实验目的
| 碳粉/g
| 铁粉/g
| 醋酸/%
| ①
| 为以下实验作参照
| 0.5
| 2.0
| 90.0
| ②
| 醋酸浓度的影响
| 0.5
|
| 36.0
| ③
|
| 0.2
| 2.0
| 90.0
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,碳粉表面发生了 (“氧化”或“还原”)反应,其电极反应式是 。
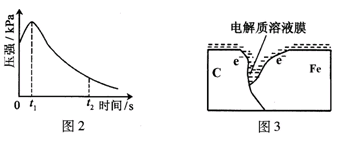
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二: ;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤和结论。
实验步骤和结论(不要求写具体操作过程):
参考答案:
(1)②2.0 ③碳粉含量的影
本题解析:
试题分析:(1)探究影响化学反应速率,每次只能改变一个变量,故有②中铁的量不变,为2.0g;③中改变了碳粉的质量,故为探究碳粉的量对速率的影响。
(2)压强与气体的物质的量成正比,从图中可以看出,气体的量开始增加,后减少,故为吸氧腐蚀;活泼金属做负极,故碳为正极,发生还原反应。
(3)从体积的影响因素着手,温度升高,体积增大
(4)基于假设一,可知,产生氢气,发送那些变化,从变化入手考虑
考点:实验设计与探究,影响化学反应速率的因素。
本题难度:困难
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772